Manganez Oksit (MnO2) Kimyasal Yapısı, Özellikleri ve Kullanımları
mangan oksit (MnO2) manganez elementi tarafından +4 oksidasyon numarası ve oksijeni içeren, inorganik bir kimyasal bileşiktir ve oksitler oluşumunda -2 oksidasyon sayısına sahiptir. Ayrıca manganez (IV) oksit ve mangan anhidrit adları ile de bilinir..
Koyu kahve siyah kahve kadar katıdır. Mineral pirolüzit, siyah ve kristalleşmiş dendritler (dallanmış uzamalar) olarak doğada bulunur. Potasyum permanganatın oksitleyici etkisi ile glikol oluşumundan sonra etilen ve potasyum permanganat arasındaki reaksiyonda siyah bir artık olarak elde edilebilir..

Cam endüstrisinde, oksitleyici madde özelliği nedeniyle çok önemlidir, çünkü demir bileşiklerinden gelen yeşil rengi ortadan kaldırır ve demirden dönüştürür..
indeks
- 1 Kimyasal yapı
- 2 Özellikler
- 3 Kullanım
- 3.1 Katalizör olarak
- 4 Sağlık üzerindeki etkileri
- 5 Kaynakça
Kimyasal yapısı
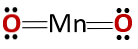
Bileşiğin kimyasal yapısı, bir metal ve metal olmayan bir maddeden oluştuğundan bekleneceği gibi bir bazik oksidin değil bir anhidritin yapısına karşılık gelir..
Bu özel durum, manganezin sahip olduğu farklı oksidasyon durumlarında üstlendiği davranıştan kaynaklanmaktadır. Böylece, +2 ve +3 oksidasyon durumları için MnO ve Mn oksitlerini oluşturur2Ey3 sırasıyla su ile reaksiyona girdiklerinde sırasıyla mangan hidroksit ve mangan hidroksit oluştururlar..
Ancak, Mn2Ey3 hafif asitli bir ortamda, bir anhidrit gibi davranır. Oksidasyon durumları ile +4, +6 ve +7, MnO2, MnO3 ve MnO4 su ile reaksiyona girdiğinde asit oluştururlar.
Hafif asitli bir ortamda MnO2 bazik bir oksit gibi davranır, böylece karşılık gelen hidroksiti oluşturabilir.

Bu durumda, bir bileşiğin bir asit veya bir baz olarak davranabileceği amfoterik özelliklerden bahsetmediği akılda bulundurulmalıdır. Bu özel bir Mn davranışı örneğidir.
özellikleri
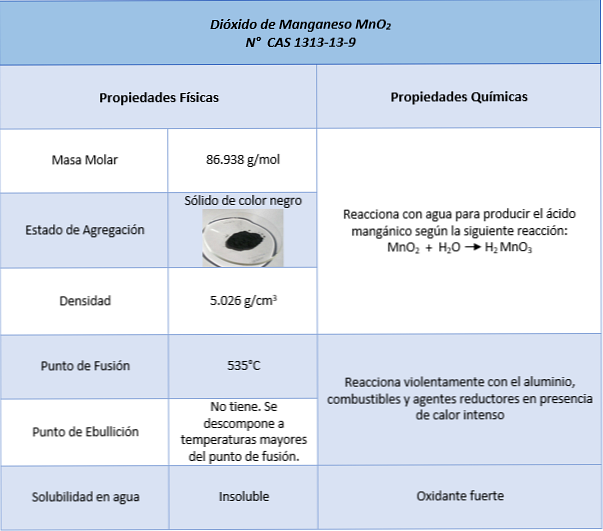
uygulamaları
- Manganez kaynağı olarak kullanılır.
- Alkalin pillerde bir oksidan olarak
- Cam, seramik ve porselen boyaları.
- Klor ve iyot elde etmede.
- Gaz halinde oksijen ve su oluşumu için hidrojen peroksitin ayrışmasında.
- Gaz oksijen ve potasyum klorür üretimi için potasyum kloratın ayrışma reaksiyonunda.
- Asetonda veya diklorometanda çözündürülür, primer alkolleri aldehilere okside eder ve ketonlara sekonder.
- Alkalin pil üretimi.
Bir katalizör olarak
Bu, H gibi sülfürlerin uzaklaştırılması için oksit indirgeme reaksiyonları için geçerlidir.2S ve Fe gibi katyonlar+2 ve Mn+2 , Bu tür bileşiklerle kirlenmiş yeraltı sularında bulunan arsenik ve radyo.
Bu kirlenme, toksik maddelerin kontrolsüz boşaltılmasıyla, kirlenmiş toprakların yıkanmasıyla veya suyun çıkarılması sırasında kimyasal elementlerin bulunmasıyla üretilebilir..
MnO2 Filtre (Filox) olarak kullanılan pirrolitten elde edilen yüksek saflık, bu safsızlık sınıfını yeraltı suyundan uzaklaştırmanın en etkili yoludur..
Sağlık üzerindeki etkiler
- Cilt ile temasından sakının.
- Temas halinde ilgili alanı yıkayın.
- Tozları solumayın.
- Gözle temasta tahriş ve kızarıklık görülür. Bol suyla yıkayın, suyun gözlerin arasından akmasına izin verin ve ciddi durumlarda tıbbi yardım çağırın..
- Cilt ile temasında tahriş ve kızarıklık görülür. Etkilenen bölgeyi bol su ve sabunla yıkayın.
- Uzun süreli cilt teması, dermatiti tetikleyerek doğal yağınızı temizler.
- Solunması grip benzeri bir duruma (metal dumanı) neden olabilir. Durum yüksek ateş, titreme, ağız kuruluğu ve boğaz, kas ağrısı ve baş ağrısı ile karakterizedir..
- Solunum yollarını tahriş edebilir ve solunum yolu enfeksiyonu insidansını artırabilir (zatürree). İnorganik manganez tuzlarının akciğerlerden emilimiyle zehirlenme olasılığı düşüktür, ancak kronik zehirlenme meydana gelebilir.
- Manganez dioksitin uzun süre toza veya buhara maruz kalması, merkezi sinir sistemini etkileyebilir ve Parkinson hastalığının gelişmesine, yürüme zorluklarına, kas spazmlarına ve davranış değişikliklerine neden olabilir.
- Yutma karın ağrısına ve mide bulantısına neden olabilir.
- Yanıcı değildir, ancak akkor malzemelerde yangının yayılmasına yardımcı olur. 535 ° C'nin üzerindeki bir sıcaklığa ısıtıldığında, madde manganez oksidi (III) Mn'ye dönüşür2Ey3 ve yanıcı olan ve yangın tehlikesini artıran oksijen. Bu durumda yangın köpük veya karbondioksit ile söndürülmelidir..
- Dökülme durumunda, bileşiği uygun kişisel korunma olmadan değiştirmeyin..
- Bileşeni, sıkıca kapalı kaplarda, soğuk ve kuru bir yerde ve organik materyal ve yanıcı materyal gibi uyumsuz maddelerden uzakta saklayın..
- Depo yeri kuru olmalı ve asit korozyonuna dayanıklı ve iyi drenajlı zeminlere sahip olmalıdır..
- Eldiven, koruyucu gözlük, buhar önleyici filtre maskeleri, toz ve duman gibi kişisel koruyucu donanımlar kullanılmalıdır..
referanslar
- B, (2015), Manganez Dioksit, Kraliyet Kimya Derneği - Kimya dünyası, chemistryworld.com adresinden alınmıştır.
- Karal, (2014), Mangneso Dioxide, Güvenlik Bilgi Formu, Alınan, karal.com.mx
- Sanal öğretmeniniz (2015/02/25). Manganez inorganik bileşikleri (özel durum 1) - Teorik ders)
- Ecured, (s.f), Manganez Dioksit, ecured.cu'dan kurtarıldı
- Angarita G, Johnny., (2017), Manganez Dioksit: Olağanüstü Bir Teknoloji. Hidroteco, hydrotecocr.com adresinden kurtarıldı
- Fernández, G., (2015), MnO Manganez Dioksit2/ aseton, Organik Kimya, Quimicaorganica.net sitesinden kurtarıldı
- Tronox, (2011), Manganez Dioksit, Güvenlik Bilgi Formu, Elde Edilen, tronox.com


