Berilyum oksit (BeO) yapısı, özellikleri ve kullanımları
berilyum oksit (BeO), yüksek mukavemeti ve elektriksel direncine ek olarak, onu, bu son özellikte metalleri bile geçerek, onu nükleer reaktörlerin bir parçası haline getiren yüksek bir ısı iletim kapasitesine sahip seramik bir malzemedir..
Sentetik bir materyal olarak kullanımına ek olarak, nadir olmasına rağmen doğada da bulunabilir. İnsan sağlığına ciddi zarar verebilecek kapasiteye sahip olduğundan, yönetimi dikkatli yapılmalıdır..
Modern dünyada, teknoloji şirketleriyle ilişkili bilim adamlarının yarı iletken malzemelerle ve havacılık endüstrisi gibi oldukça özel uygulamalar için gelişmiş malzemeler geliştirmek için araştırmalar yaptıkları görülmüştür..
Bunun sonucu, son derece kullanışlı özellikleri ve yüksek dayanıklılıkları sayesinde bize zaman içinde ilerleme fırsatı vererek teknolojimizi daha yüksek seviyelere çıkarmamıza olanak tanıyan maddelerin keşfi olmuştur..
indeks
- 1 Kimyasal yapı
- 2 Özellikler
- 2.1 Elektriksel iletkenlik
- 2.2 Isı iletkenliği
- 2.3 Optik özellikler
- 2.4 Sağlık riskleri
- 3 Kullanım
- 3.1 Elektronik uygulamalar
- 3.2 Nükleer uygulamalar
- 3.3 Diğer uygulamalar
- 4 Kaynakça
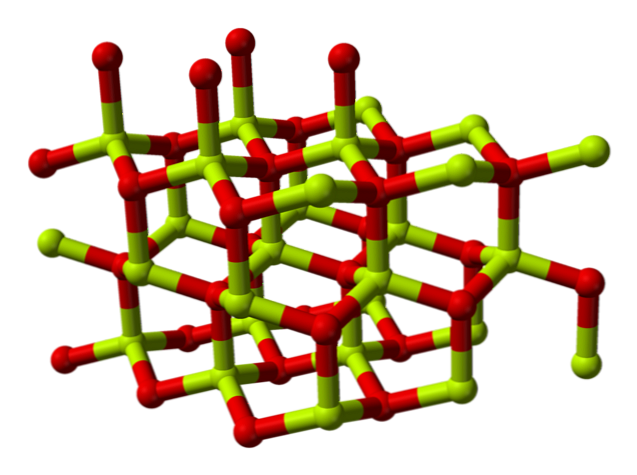
Kimyasal yapısı
Berilyum oksit molekülü (ayrıca denir) "Beryllia") Hem tetrahedral oryantasyonda koordine edilmiş bir berilyum atomu hem de bir oksijen atomundan oluşur ve wurtzites adı verilen altıgen kristalli yapılarda kristallendirilir.
Bu kristaller, Be tarafından işgal edilen dörtyüzlü merkezlere sahiptir.2+ ve O2-. Yüksek sıcaklıklarda, berilyum oksidin yapısı dörtgen hale gelir.
Berilyum oksidin elde edilmesi üç yöntemle gerçekleştirilir: berilyum karbonatın kalsinasyonu, berilyum hidroksitin dehidrasyonu veya berilyum metalinin tutuşturulması. Yüksek sıcaklıklarda oluşan berilyum oksit etkisizdir, ancak birkaç bileşik tarafından çözülebilir.
BECO3 + Isı → BeO + CO2 (Kalsinasyon)
Olmak (OH)2 → BeO + H2O (Dehidrasyon)
2 Olun + O2 → 2 BeO (Ateşleme)
Son olarak, berilyum oksit buharlaştırılabilir ve bu durumda iki atomlu moleküller şeklinde sunulacaktır..
özellikleri
Berilyum oksit, doğada bazı kompleks manganez demir birikintilerinde bulunan beyaz bir mineral olan bromelit olarak ortaya çıkar, ancak daha yaygın olarak sentetik formunda bulunur: toz halinde üretilen beyaz amorf bir katı.
Ayrıca, üretim sırasında sıkışmış olan yabancı maddeler oksit numunesine çeşitli renkler verecektir..
Erime noktası 2507 ° C, kaynama noktası 3900 ° C'dir ve yoğunluğu 3,01 g / cm'dir.3.
Aynı şekilde, kimyasal stabilitesi oldukça yüksektir, sadece 1000 ºC'ye yakın sıcaklıklarda su buharıyla reaksiyona girer ve yüksek sıcaklıklarda erimiş metallerin karbon azaltma işlemlerine ve saldırılarına karşı koyabilir.
Ek olarak, mekanik dayanımı iyidir ve ticari kullanımlara uygun tasarım ve imalatlarla geliştirilebilir..
Elektriksel iletkenlik
Berilyum oksit çok kararlı bir seramik malzemedir ve bu nedenle alümina ile birlikte en iyi elektriksel yalıtım malzemelerinden biri yapan oldukça yüksek elektriksel direncine sahiptir.
Bu nedenle, bu malzeme genellikle özel yüksek frekanslı elektrikli cihazlar için kullanılır..
Termal iletkenlik
Berilyum oksit, termal iletkenlik açısından büyük bir avantaja sahiptir: metal olmayanlar arasında en iyi ikinci ısı iletici malzeme olarak bilinir, oldukça elmaslı ve daha pahalı ve nadir bulunan bir malzeme olarak sadece elmas ile aşılır.
Metallere gelince, yalnızca bakır ve gümüş, ısıyı berilyum oksitten daha iyi ileterek ısıyı daha iyi bir malzeme haline getirir..
Mükemmel ısı iletme özelliklerinden dolayı, bu madde refrakter malzemelerin üretiminde yer almaktadır..
Optik özellikleri
Kristalin özellikleri nedeniyle berilyum oksit, bazı düz ekranlarda ve fotovoltaik hücrelerde ultraviyole şeffaf malzemenin uygulanması için kullanılır.
Aynı şekilde, çok yüksek kalitede kristaller üretilebilir, bu nedenle bu özellikler kullanılan imalat işlemine göre gelişir.
Sağlık riskleri
Berilyum oksit, ilk önce bu maddenin tozlarının veya buharlarının sürekli solunması ile bağlantılı olan kanserojen özelliklere sahip olduğu için büyük dikkatle kullanılması gereken bir bileşiktir..
Oksitin bu fazlarındaki küçük parçacıklar, akciğerlere yapışır ve tümörlerin oluşumunu ya da berylliosis olarak bilinen bir hastalığı üretebilir..
Berylliosis; verimsiz solunum, öksürük, kilo kaybı ve ateş ile akciğerlerde veya diğer etkilenen organlarda granülom oluşumuna neden olan medyan mortalite oranına sahip bir hastalıktır..
Berilyum oksidin cilde doğrudan temas etmesi, aşındırıcı ve tahriş edici olması ve cilt yüzeyinde ve mukoza zarlarında hasara yol açabileceği gibi sağlık tehlikeleri de vardır. Solunum yolları ve eller bu malzeme ile çalışırken, özellikle toz halindeyken korunmalıdır.
uygulamaları
Berilyum oksidin kullanımı temel olarak üçe ayrılır: elektronik, nükleer ve diğer uygulamalar.
Elektronik uygulamalar
Isıyı yüksek bir seviyeye aktarabilme kabiliyeti ve iyi elektrik direnci, berilyum oksidi bir ısı emici olarak büyük bir kullanım alanı haline getirmiştir..
Kullanımı, yüksek elektrik akımlarını işleyen ekipmanın yanı sıra, yüksek kapasiteli bilgisayarların içindeki devrelerde de kanıtlanmıştır..
Berilyum oksit, X-ışınları ve mikrodalgalar için saydamdır, bu nedenle bu radyasyona karşı pencerelerde, ayrıca antenler, iletişim sistemleri ve mikrodalga fırınlarda kullanılır..
Nükleer uygulamalar
Nötronları hafifletme ve yapısını radyasyon bombardımanı altında tutma kabiliyeti berilyum oksitin nükleer reaktörlerin yapımında rol oynamasını sağlamıştır ve ayrıca gazlar tarafından soğutulmuş yüksek sıcaklık reaktörlerinde de uygulanabilir..
Diğer uygulamalar
Düşük berilyum oksit yoğunluğu, roket motorlarında ve kurşun geçirmez yeleklerde düşük ağırlıklı bir seçeneği temsil edebileceğinden, havacılık ve askeri teknoloji endüstrilerine ilgi duymuştur..
Son olarak, son zamanlarda metalurji endüstrilerinde metallerin füzyonunda refrakter bir malzeme olarak uygulanmıştır..
referanslar
- Pubchem. (N.D.). Berilyum Oksit. Pubchem.ncbi.nlm.nih.gov adresinden alındı
- Reade. (N.D.). Beryllia / Beryllium Oxide (BeO). Reade.com adresinden kurtarıldı
- Research, C. (s.f.). Berilyum Oksit - Berilya. Azom.com sitesinden alındı
- Services, N. J. (s.f.). Berilyum Oksit. Nj.gov'dan alındı
- Vikipedi. (N.D.). Berilyum Oksit. En.wikipedia.org sitesinden alındı


