Bor oksit (B2O3) yapısı, özellikleri, adlandırılması ve kullanımı
bor oksit veya borik anhidrit, kimyasal formülü B olan inorganik bir bileşiktir.2Ey3. Periyodik tablonun p bloğunun bor ve oksijen elementleri ve ilgili grupların kafaları daha fazla olduğundan, aralarındaki elektronegatiflik farkı çok yüksek değildir; bu nedenle, B bekleniyor olması bekleniyor2Ey3 doğada kovalent olmak.
B2Ey3 bir erime fırını içindeki ve 750 ° C'lik bir sıcaklıkta boraksın konsantre sülfürik asit içinde çözülmesi ile hazırlanır; termal olarak dehidrasyon yapan borik asit, B (OH)3, yaklaşık 300 ° C sıcaklıkta; veya ayrıca, diboran reaksiyonun (B) bir ürünü olarak da oluşturulabilir.2'H6) oksijenli.

Bor oksit yarı saydam camsı veya kristalimsi bir görünüme sahip olabilir; İkincisi, toz halinde öğütülerek elde edilebilir (üst resim).
İlk bakışta görünmese de, B olarak kabul edilir.2Ey3 en karmaşık inorganik oksitlerden biri olarak; sadece yapısal açıdan değil, aynı zamanda cam ve seramiklerin matrikslerine eklendikleri değişken özelliklerinden dolayı.
indeks
- 1 Bor oksidin yapısı
- 1.1 Birim BO3
- 1.2 Kristal yapı
- 1.3 Vitröz yapı
- 2 Özellikler
- 2.1 Fiziksel görünüm
- 2.2 Moleküler kütle
- 2.3 Tat
- 2.4 Yoğunluk
- 2.5 Erime noktası
- 2.6 Kaynama noktası
- 2.7 Kararlılık
- 3 İsimlendirme
- 4 Kullanım
- 4.1 Bor trihalidlerin sentezi
- 4.2 Böcek öldürücü
- 4.3 Metal oksitlerin çözücüsü: gözlük, seramik ve bor alaşımlarının oluşumu
- 4.4 Ciltçi
- 5 Kaynakça
Bor oksidin yapısı
BO Birimi3
B2Ey3 kovalent bir katı olduğu için teoride yapısında B iyonları yoktur.3+ ne de O2-, ancak B-O linkleri. Değerlik bağ teorisine (VTE) göre bor, sadece üç kovalent bağ oluşturabilir; Bu durumda, üç B-O bağlantısı. Bunun bir sonucu olarak, beklenen geometri trigonal, BO olmalıdır3.
BO molekülü3 elektronlarda, özellikle oksijen atomlarında eksiktir; ancak, birkaçı bu eksikliği sağlamak için birbirleriyle etkileşime girebilir. Yani, üçgenler BO3 Bir oksijen köprüsünü paylaşarak katılırlar ve farklı yönlere yönlendirilmiş uçakları ile uzayda üçgen sıralı ağlar olarak dağıtılırlar..
Kristal yapısı
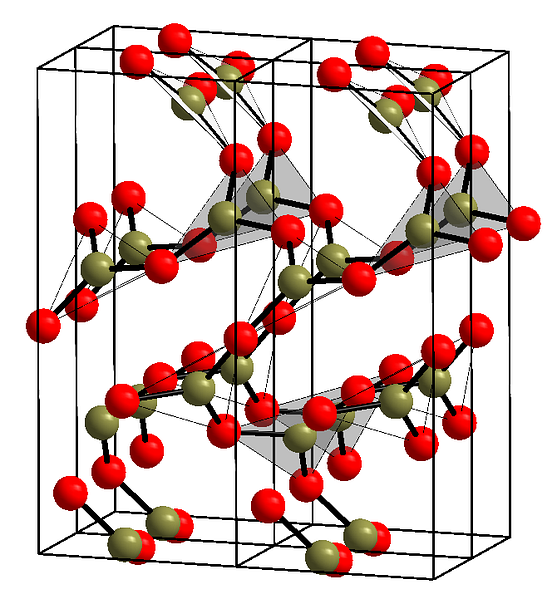
Üstteki resim, BO üçgenleri olan bahsedilen sıraların bir örneğini göstermektedir3. Dikkatli bakarsanız, uçakların tüm yüzleri okuyucuya değil başka bir tarafa işaret eder. Bu yüzlerin yönelimleri B'nin nasıl tanımlandığından sorumlu olabilir.2Ey3 belirli bir sıcaklık ve basınçta.
Bu ağlar uzun menzilli yapısal bir desene sahip olduğunda, birim hücresinden oluşturulabilen kristal bir katıdır. B'nin söylendiği yer burası.2Ey3 İki kristal polimorfu vardır: α ve and.
Α-B2Ey3 ortam basıncında (1 atm) oluşur ve kinetik olarak kararsız olduğu söylenir; Aslında, bu bor oksit muhtemelen zor bir kristalleşme bileşiği olmasının nedenlerinden biridir.
Diğer polimorf, β-B2Ey3, GPa aralığında yüksek basınçlarda elde edilir; bu nedenle yoğunluğu α-B'ninkinden büyük olmalıdır2Ey3.
Vitröz yapı
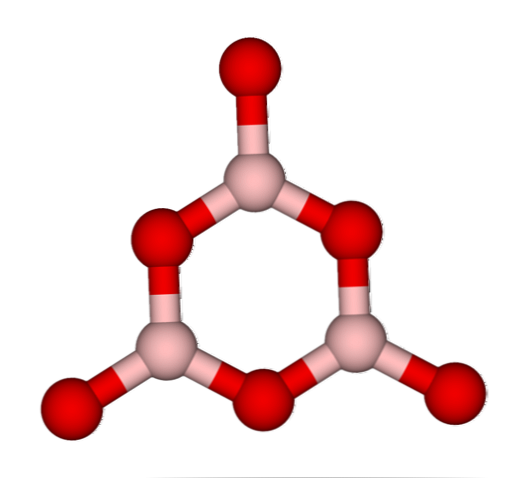
Ağları bo3 doğal olarak amorf yapılarını benimseme eğilimindedirler; bunlar katıdaki molekülleri veya iyonları tanımlayan bir düzen içermemesidir. B'yi sentezleyerek2Ey3 baskın hali şekilsizdir ve kristal değildir; Doğru bir deyişle: Kristalin daha katı bir vitröz.
B denildiği söylenir.2Ey3 BO ağları oluştuğunda vitröz veya şekilsizdir.3 Dağınıklar. Sadece bu değil, aynı zamanda bir araya gelme şeklini de değiştiriyorlar. Trigonal bir geometride düzenlenmek yerine, araştırmacıların boroksol halkası dediği şeyi oluşturmak için bağlanırlar (en iyi resim)..
Üçgen ve altıgen üniteler arasındaki bariz farkı dikkate alın. Üçgen olanlar B'yi karakterize eder2Ey3 kristalin ve altıgen B'ye2Ey3 vitreus. Bu amorf faza atıfta bulunmanın bir başka yolu, bor camdır ya da bir formüldür: g-B2Ey3 ('g' İngilizce kelimesi camsı kelimesinden gelir).
Böylece, G-B ağları2Ey3 bo birimleri, boroksol halkalarından oluşur3. Ancak, g-B2Ey3 α-B'ye kristalize olabilir2Ey3, bu, halkaların üçgenlere dönüşümünü ima eder ve ayrıca elde edilen kristalleşme derecesini tanımlar..
özellikleri
Fiziksel görünüm
Renksiz ve camsı bir katıdır. Kristal formunda beyazdır.
Moleküler kütle
69.6182 g / mol.
lezzet
Biraz acı
yoğunluk
-Kristal: 2.46 g / mL.
-Vitreus: 1.80 g / ml.
Erime noktası
Tam olarak tanımlanmış bir erime noktasına sahip değildir, çünkü ne kadar kristalin veya vitröz olduğuna bağlıdır. Saf kristal form 450 ° C'de erir; bununla birlikte, camsı form 300 ila 700 ° C arasında değişen bir sıcaklık aralığında erir..
Kaynama noktası
Yine, rapor edilen değerler bu değer ile eşleşmiyor. Görünüşe göre sıvı bor oksit (kristallerinden veya camından erimiş) 1860ºC'de kaynar.
kararlılık
Borik aside dönüşmek için nemi emdiği için kuru tutulmalıdır, B (OH)3.
terminoloji
Bor oksit, aşağıdaki gibi başka şekillerde isimlendirilebilir:
-Diboro trioksit (sistematik isimlendirme).
-Bor oksit (III) (stok isimlendirme).
-Borik oksit (geleneksel isimlendirme).
uygulamaları
Bor oksit kullanımlarından bazıları:
Bor trihalidlerin sentezi
B'den2Ey3 sentezlenebilir bor trihalidleri, BX3 (X = F, Cl ve Br). Bu bileşikler Lewis asitleridir ve onlarla yeni özelliklere sahip diğer türevleri elde etmek için belirli atomlara bor atomları verilmesi mümkündür.
böcek ilacı
Borik asit ile katı bir karışım, B2Ey3-B (OH)3, evcil bir böcek ilacı olarak kullanılan bir formülü temsil eder..
Metalik oksitlerin çözücüsü: gözlük, seramik ve bor alaşımlarının oluşumu
Sıvı bor oksit, metal oksitleri çözebilir. Bu elde edilen karışımdan, bir kez soğutulduğunda, katılar bor ve metallerle elde edilir..
B miktarına bağlı olarak2Ey3 tekniğin yanı sıra metal oksit türünün yanı sıra, çok çeşitli gözlükler (borosilikatlar), seramikler (nitritler ve bor karbürleri) ve alaşımları (sadece metaller kullanılıyorsa) alabilirsiniz.
Genel olarak, cam veya seramik, daha fazla dayanıklılık yanında daha fazla güç ve dayanıklılık kazanır. Gözlük durumunda, optik lensler ve teleskoplar ve elektronik cihazlar için kullanılırlar.
bağlayıcı madde
Çelik eritme fırınlarının yapımında magnezyum esaslı refrakter tuğlalar kullanılır. İçlerinde bor oksit bağlayıcı olarak kullanılır ve sıkıca bağlanmasına yardımcı olur..
referanslar
- Shiver ve Atkins. (2008). İnorganik kimya (Dördüncü baskı). Mc Graw Hill.
- Vikipedi. (2019). Bor trioksit. Alınan: en.wikipedia.org
- Pubchem. (2019). Borik oksit. Alınan: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borix oksit. 20 Katır Takımı Boraks. Alınan: borax.com
- A. Mukhanov, O. O. Kurakevich ve V. L. Solozhenko. (N.D.). Borun Sertliği Üzerine (III) Oksit. LPMTMCNRS, Paris Paris Üniversitesi, Villetaneuse, Fransa.
- Hansen T. (2015). B2Ey3 (Borik Oksit). Alınan: digitalfire.com


