Kalsiyum Hidroksit Formülü, Özellikleri, Tepkime ve Kullanım Alanları
kalsiyum hidroksit, hidratlanmış kireç veya sönmüş kireç olarak da bilinir, Ca (OH) formülüne sahip inorganik bir bileşiktir2.
Kalsiyum hidroksit, tüm metal hidroksit gibi, magnezyum hidroksit (Mg (OH)) ile aynı olan polimerik bir yapıya sahiptir.2) ayrıca brucita olarak da bilinir.
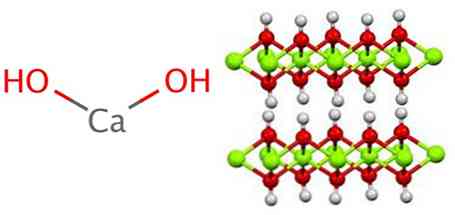
Bu yapıda hidrojen köprülerinin oluştuğu görülebilir. Kalsiyum hidroksit, kireç veya çabuk kireç olarak da bilinen kalsiyum oksidin, aşağıdaki reaksiyona göre suyla reaksiyona sokulmasıyla endüstriyel olarak sentezlenir:
CaOH + H2O → Ca (OH)2
Laboratuarda ayrıca sulu kalsiyum klorür ve sodyum hidroksit arasındaki reaksiyonla hazırlanır..
Kalsiyum hidroksit doğal olarak meydana gelir, ancak nadiren bazı volkanik ve metamorfik kayaçlarda bulunan portlandit olarak mineral formunda bulunur. (Kalsiyum hidroksit Formülü - Kalsiyum hidroksit Kullanımları, Özellikleri, Yapısı ve Formülü, 2005-2017).
Bu bileşik ayrıca, çimento, çözücü ve endüstriyel temizleyiciler (inşaat ürünleri gibi), yer sıyırıcıları, tuğla temizleyicileri, çimento kalınlaştırıcı ürünler ve diğerleri içinde yaygın olarak bulunur..
Sulu çözelti genellikle limewater olarak adlandırılır. Kireç suyu kalsiyum hidroksitin saf su içinde karıştırılması ve Ca (OH) fazlalığının süzülmesi ile hazırlanır.2 çözünmemiş.
Kireç suyuna fazla kalsiyum hidroksit ilave edildiğinde, bir kalsiyum hidroksit taneciklerinin bir süspansiyonu elde edilir, bu da sütlü bir görünüm verir; bu durumda, genel olarak kireç sütü ismine sahiptir. Kireç sütü veya doymuş bir kireç çözeltisi (kireç suyu) 12,3 pH değerine sahiptir, bazik bir yapıya sahiptir..
Kalsiyum hidroksitin fiziksel ve kimyasal özellikleri
Kalsiyum hidroksit, kokusuz beyaz veya renksiz bir tozdur. Sulu çözeltide (doymuş çözeltiler) çözünmemiş kalsiyum hidroksitin süpernatanı nedeniyle sütlü bir görünüme sahiptir..
Doymamış çözeltiler genellikle hafif, toprak kokusu ve acı alkali kalsiyum hidroksit tadı olan berrak ve renksiz çözeltilerdir. Bileşiğin görünümü Şekil 3'te gösterilmektedir (Royal Society of Chemistry, 2015).

Kalsiyum hidroksit, 74.093 g / mol moleküler ağırlığa ve katı halde 2.211 g / cm3 yoğunluğa sahiptir. 580 santigrat derece erime noktasına sahiptir. Suda zayıf şekilde çözünür, 0 ° C'de litre başına 1,89 gram, 20 ° C'de litre başına 1,73 gram ve 100 ° C'de litre başına 0,66 gram çözülebilir..
Gliserolde ve asit çözeltilerinde çözünür. Alkolde çözünmez (Ulusal Biyoteknoloji Bilgi Merkezi, S.F.).
Kalsiyum hidroksit, ılımlı bir baz olan limewater adlı bir çözelti üretmek için suda kısmen çözülür. Kireç suyu veya Ca (OH)2 (aq) Tuz oluşturmak için asitlerle reaksiyona girer ve alüminyum gibi bazı metallere saldırabilir. Kireç suyu, karbonasyon denilen yararlı bir işlem olan kalsiyum karbonat oluşturmak için karbon dioksit ile kolayca reaksiyona girer:
Ca (OH)2 + CO2 → CaCO3 + 'H2Ey
Nitroparafinler, nitrometan, nitropropan, vb., Kalsiyum hidroksit gibi inorganik bazlarla tuzlar oluşturur. Bu kuru tuzlar patlayıcıdır. Bileşik kimyasal olarak sodyum hidroksit (NaOH) veya sodyum okside (Na) benzer2O). Bunlar tuzları ve suyu oluşturmak için asitleri ekzotermik olarak nötralize eder.
Bu malzemelerin suyla karıştırılması, baz çözülür veya seyreltilirken güvenli olmayan miktarda ısı üretebilir. Bazlar, metal oksitler veya hidroksitleri oluşturmak ve hidrojen gazı oluşturmak için bazı metallerle (alüminyum ve çinko gibi) reaksiyona girer..
Bazlar, polimerize edilebilir organik bileşiklerde, özellikle epoksitlerde polimerizasyon reaksiyonlarını başlatabilir. Yanıcı ve / veya toksik gazlar, amonyum tuzları, nitritler, halojenli organik maddeler, çeşitli metaller, peroksitler ve hidroperoksitlerle üretilebilir. Bu tip bir bileşik genellikle bir katalizör görevi görür (Kimyasal Veri Sayfası CALCIUM HYDROXIDE, S.F.).
Tepkime ve tehlikeler

Kalsiyum hidroksit, güçlü asitlerle uyumlu olmamasına rağmen stabil bir bileşiktir. Tahriş edici bir bileşik olarak sınıflandırılır ve tehlikeleri arasında vurgulayabileceğimiz şeyler:
Gözlere (kornea hasarına veya körlüğe neden olurlar) ve cilde (iltihap ve kabarmalara neden olurlar) aşındırıcıdır..
Tozun solunması mide-bağırsakta veya solunum yollarında yanma, hapşırma ve öksürük ile karakterize tahrişe neden olur. Şiddetli aşırı maruz kalma, akciğer hasarı, asfiksi, bilinç kaybı veya ölüme neden olabilir. Göz iltihabı kızarıklık, tahriş ve kaşıntı ile karakterizedir (Malzeme Güvenlik Bilgi Formu Kalsiyum hidroksit, 2013).
Gözlerin düşük seviyede tozda tekrar tekrar maruz kalması tahrişe ve cilt üzerinde yerel tahrişe veya dermatite neden olabilir. Tozun tekrar tekrar solunması, değişken derecede solunum tahrişi veya akciğerde hasara neden olabilir.
Bu kimyasal madde göze temas ederse, derhal alt ve üst göz kapaklarını kaldırarak bol miktarda su ile yıkanmalıdır. Acil tıbbi yardım alınmalıdır. Bu kimyasal maddeyle çalışırken kontakt lens kullanılmamalıdır.
Bu kimyasal cilde temas ederse, su ve sabunla kirlenmiş cildin derhal durulanması gerekir. Bu kimyasal elbiseye nüfuz ederse, hemen elbiseyi çıkarın ve cildi suyla yıkayın. Tahriş yıkamadan sonra da devam ederse, tıbbi yardım isteyin.
Bu kimyasalın büyük miktarda solunması durumunda, maruz kalan kişi derhal temiz havaya çıkarılmalıdır. Solunum durduysa, kurbanı sıcak ve istirahatte tutarak ağızdan ağıza resüsitasyon uygulayın. En kısa sürede tıbbi yardım alın.
Yutulması halinde hemen bir doktora başvurun, mümkünse kabı veya etiketi gösterin (Kalsiyum hidroksit zehirlenmesi, 2017).
Taşıma ve depolama
- Bileşik kuru bir kapta tutulmalıdır.
- Tozu yutmayın veya solumayın.
- Bu ürüne asla su eklenmemelidir.
- Havalandırmanın yetersiz olması durumunda, uygun solunum ekipmanı getirin.
- Cilt ve gözlerle temasından kaçının.
- Asit olarak uyumsuzluktan uzak tutun.
- Kabı sıkıca kapalı tutun.
- Kabı serin ve iyi havalandırılan bir yerde saklayın. 25 santigrat derecenin üzerinde saklamayın.
Kullanımlar ve uygulamalar

Kalsiyum hidroksit büyük ölçekte üretilir, kolayca kullanılır ve genellikle ucuzdur, bu nedenle kayda değer kullanım ve uygulamalar vardır..
Kalsiyum hidroksitin önemli bir uygulaması, suda ve atık su arıtımında topaklanmaya benzer. Sudan daha küçük parçacıkların uzaklaştırılmasına yardımcı olan ve daha hafif bir ürün ortaya çıkaran kabarık yüklü bir katı oluşturur..
Bu uygulama düşük maliyetli ve düşük kalsiyum hidroksit toksisitesi ile sağlanır. Ayrıca, suyun pH'ını yükseltmek için tatlı suyun arıtılmasında da kullanılır. Amaç, boruların, bazik suyun asitli olduğu yerlerde korozyona uğramamasıdır..
Bir başka harika uygulama da, sodyum hidroksit üretiminde kullanıldığı kağıt endüstrisinde. Bu dönüşüm, kağıt hamuru ekstraksiyonunda kullanılan bilinen kraft işleminin bir bileşenidir..
Karbon dioksit temizleyici gibi yaşam destek sistemlerinde, özellikle kapalı devre dalış solunum maskelerinde, lityum hidroksitin daha yakıcı olduğu riskli olarak kabul edilir..
Kireç harçları ile ağartma ve sıva yapımında kullanılır. Yol yapımında, kalsiyum hidroksit toprağın kalitesini iyileştirmeye hizmet eder.
Ulusal Sağlık Enstitüleri'ne göre, kalsiyum hidroksit dişçilikte antimikrobiyal olarak yaygın bir şekilde kullanılmaktadır ve apikal bir bariyer olarak bilinen koruyucu bir tabaka oluşturmak için tercih edilen bir maddedir..
Apikal bariyerler genellikle endodontik cerrahinin özellikle zor olacağı durumlarda pulpal nekrozdan kaçınmanın bir aracı olarak kullanılır; bu genellikle olgunlaşmamış bir kalıcı dişin sonucudur..
Kalsiyum hidroksit bir enfeksiyonun var olduğu bir dişin dezenfekte edilmesine yardımcı olabileceğinden, endodontik cerrahi hazırlıklarında ağrı ve iltihabı azaltmak için kısa süreli bir tedavi olarak kullanılabilir (Gottfried Schmalz, 2009).
Atmosferik CO2 oranını düşürdüğü ve sera etkisini azalttığı için deniz suyu için bir katkı maddesi görevi görür..
Metallerin üretiminde, atmosfere salınmadan önce floritler ve kloritler gibi asitleri nötralize etmek için atık gaz akışına kireç enjekte edilir..
Kalsiyum hidroksit, bazı saç gevşetme ürünlerinde aktif alkalin bileşen olarak kullanılır..
Cornell Malzeme Araştırma Merkezi'ne göre, kalsiyum hidroksit kıvırcık saçları düzleştirebilir çünkü doğal olarak kıvırcık saçlarda daha yüksek konsantrasyonlarda bulunan amino asitler sisteinleri bağlayan disülfit bağlarını kırar. Bu bağların kırılması ve kalsiyum hidroksit ile kaplanması, işlem görmüş saçın fiziksel yapısını kalıcı olarak değiştirir.
Bordeaux karışımında, kalsiyum hidroksit çözeltiyi nötralize etmeye ve uzun süreli bir fungisit oluşturmaya yarar.
Petrol rafinerisi endüstrisinde, yağ katkı maddelerinin (salisilatlar, sülfikler, fenoller), petrokimya endüstrisinde, çeşitli markaların katı yağ üretimi için ve ayrıca kalsiyum stearat üretimi için kimya endüstrisinde kullanılır. . Genellikle karbondioksit ve gaz emiliminin incelenmesi için kullanılır.
Kalsiyum hidroksit, fren balatalarının imalatında, boyama ve dekorasyon için kuru karışımların hazırlanmasında ve ayrıca pestisitler için karışımların imalatında kullanılır..
Ayrıca resif akvaryumlarında mercan yetiştiriciliği için kalsiyum takviyesi ve pH / karbonat tamponu olarak kullanılır..
Keneler, pire, böcekler ve larvalar da dahil olmak üzere, sürünen böceklerin çoğu, "alternatif" bir doğal insektisittir. (Russiver, 2015).
Kalsiyum hidroksit, deri üretimi için saçları hayvan derilerinden ayırmada etkili bir çözümdür..
Kalsiyum hidroksit ve ılık su karışımı, taze derilerin dört güne kadar ıslatılması ve sık sık çalkalanması gereken bir banyo oluşturur. Bu işlem saçı ve cildi gevşetir, öyle ki genellikle elle çıkarılabilir..
Düşük toksisitesine ve temel özelliklerinin yumuşaklığına bağlı olarak, sönmüş kireç gıda endüstrisinde yaygın olarak kullanılır:
- Şeker endüstrisindeki şeker kamışı veya şeker pancarının ham suyunu açıklığa kavuşturmak, alkollü içecekler ve alkolsüz içecekler, turşular ve diğer yiyecekler için suyun işlenmesi.
- Mısır ekmeği hazırlayın (mısır unu ile bir araya gelin). Kireçle pişirilmiş mısır, niastamal haline dönüştürülür ve bu, niasinin biyoyararlanımını önemli ölçüde arttırır, ayrıca daha lezzetli ve sindirimi kolay olan.
- Gıda ve ilaç kullanımı için tuz üretiminde bir tuzlu su kalsiyum ve magnezyum karbonat tuzunu temizleyin.
- Portakal suyu ve bebek maması gibi meyveli içecekleri takviye edin (BAUM, 2013).
referanslar
- BAUM, J. (2013, 16 Ağustos). Kalsiyum Hidroksit kullanır. Livestrong.com adresinden alındı: livestrong.com.
- Kalsiyum hidroksit Formülü - Kalsiyum hidroksit Kullanımı, Özellikleri, Yapısı ve Formülü. (2005-2017). Softschools.com adresinden alındı.
- Kalsiyum hidroksit zehirlenmesi. (2017, 7 Şubat). Medlineplus.gov sitesinden alındı..
- Kimyasal Veri Sayfası CALCIUM HYDROXIDE. (S.F.). Cameochemicals.noaa.gov adresinden alındı.
- Gottfried Schmalz, D.A. (2009). Diş Malzemelerinin Biyouyumluluğu. Berlin: ilkbahar.
- Malzeme Güvenlik Bilgi Formu Kalsiyum hidroksit. (2013, 21 Mayıs). Sciencelab'den alındı: sciencelab.com.
- Ulusal Biyoteknoloji Bilgi Merkezi. (S.F.). PubChem Bileşik Veritabanı; CID = 6093208. Pubchem.ncbi.nlm.nih.gov adresinden alındı.
- Kraliyet Kimya Derneği. (2015). Kalsiyum hidroksit. ChemSpider'den: chemspider.com.
- Russiver, M. (2015, 17 Ağustos). Kalsiyum hidroksit ne için kullanılır? Quora'dan alındı: quora.com.


