Sodyum Hidrit (NaH) Özellikleri, Tepkime, Tehlikeler ve Kullanımlar
sodyum hidrit NaH formüllü bir inorganik bileşiktir. Sodyum ve hidrit arasında bir iyonik bağ vardır. Yapısı şekil l'de gösterilmektedir. Tuzlu hidritleri temsil eder, yani boran, metan, amonyak gibi daha moleküler hidritlerin aksine, Na + ve H-iyonlarından oluşan, toza benzer bir hidrit olduğu anlamına gelir. ve su.
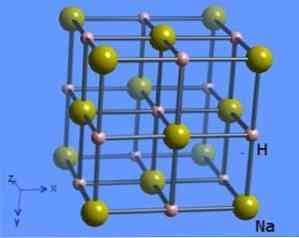
Kristal yapı, her bir sodyum molekülünün oktahedral bir şekle sahip 8 hidrit iyonu ile çevrili olduğu ve şekil 2'de gösterildiği, bir koordinasyon numarası 6'ya sahiptir (Mark Winter [Sheffield ve WebElements Ltd, 1993-2016).
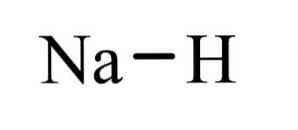
Bileşik, sodyum ve hidrojen gazı (Sodyum hidrit Formül - Sodyum hidrit Kullanımları, Özellikleri, Yapısı ve Formülü, 2005-2017) arasındaki doğrudan reaksiyonla hazırlanır:
H2 + 2Na → 2NaH
Sodyum hidrit ticari olarak güvenli kullanım için mineral yağ içerisinde ağırlıkça% 60'lık bir dağılım formu (ağırlıkça ağırlık yüzdesi) olarak satılır (SODIUM HYDRIDE, sf.).
indeks
- 1 Sodyum hidrürün fiziksel ve kimyasal özellikleri
- 2 Tepkime ve tehlikeler
- 3 Kullanım
- 4 Kaynakça
Sodyum hidrürün fiziksel ve kimyasal özellikleri
Sodyum hidrit, genellikle gri veya gümüş renkte elde edilmesine rağmen, saf olduğunda beyaz bir katıdır. Görünümü şekil 3'te gösterilmiştir..

NaH, 23.99771 g / mol moleküler ağırlığa, 1.396 g / ml yoğunluğa ve 800 ° C erime noktasına sahiptir (Royal Society of Chemistry, 2015). Amonyak, benzen, karbon tetraklorür ve karbon disülfürde çözünmez (Ulusal Biyoteknoloji Bilgi Merkezi, s.)..
Bileşik aşırı derecede kararsız. Saf NaH havada kolayca tutuşabilir. Havada bulunan suyla temas ettiğinde, yüksek derecede yanıcı hidrojen salgılar..
Havaya ve neme açık olduğunda, NaH, reaksiyona göre, güçlü aşındırıcı sodyum hidroksit (NaOH) bazına kolayca hidrolize edilir:
NaH + H20 → NaOH + H2
Bu reaksiyonda, sodyum hidrürün bir baz gibi davrandığı gözlenebilir. Bu elektronegativite nedeniyle.
Sodyum, hidrojenden (≈2.1) çok daha düşük bir elektronegatifliğe (≈1.0) sahiptir; bu, hidrojenin, elektron yoğunluğunu kendine doğru çekeceği, sodyumdan bir katyon ve anyon oluşturmak için sodyumdan uzaklaştığı anlamına gelir hidrit.
Bir bileşiğin bir Brønsted asidi olması için, elektron yoğunluğunu hidrojenden ayırması, yani onu oksijen, flor, azot vb. Gibi elektronegatif bir atoma bağlaması gerekir. Ancak o zaman resmen H + olarak tanımlanabilir ve bu şekilde ayrıştırılabilir.
Bir hidrid H- olarak daha iyi tanımlanmıştır ve serbest bir çift elektron vardır. Dolayısıyla, bir Brønsted asididir, bir asit değildir. Aslında, Brønsted asit / baz tanımını Lewis'in yaptığı gibi uzatırsanız, sodyum (Na +) 'nın buradaki asit türü olduğu sonucuna varacaksınız..
H bazının ve H + asidinin Brønsted asit / baz reaksiyon ürünü H2 olur. Asit hidrojeni doğrudan sudan çıkarıldığı için, reaksiyonun termodinamik olarak tercih edilmemesi durumunda bile dengeyi değiştiren hidrojen gazı kabarcıklı olabilir..
Sodyum hidroksit verecek şekilde Na + katyonunun geri kalanıyla yazılabilecek OH-iyonları bırakılabilir (Su ile reaksiyona girdiğinde neden katı sodyum hidrür esaslıdır ve asit değildir?, 2016).
Tepkime ve tehlikeler
Bileşik güçlü bir indirgeyici maddedir. Camdaki SiO2'ye saldırır. HF, HC1, HBr ve HI oluşturmak için gaz F2, Cl2, Br2 ve I2 (100 ° C'nin üzerindeki sıcaklıklarda ikincisi) ile temas halinde tutuşur.
Na2S ve H2S verecek şekilde sülfürle reaksiyona girer. Dimetil sülfoksit ile patlayıcı reaksiyona girebilir. Asetilen ile -60 ° C'de bile şiddetli reaksiyona girer. Flor içinde kendiliğinden yanıcıdır.
Etil-2,2,3-trifloropropiyonat içinde bir polimerizasyon reaksiyonu başlatır, böylece ester şiddetli bir şekilde ayrışır. Dietil süksinat ve etil trifloroasetat reaksiyonundaki mevcudiyet, patlamalara neden olmuştur (SODIUM HYDRIDE, 2016).
Sodyum hidrür su ile reaksiyona girme olasılığı olan yan ürünlerden kaynaklandığı için deri veya gözler için aşındırıcı olarak kabul edilir..
Göz ile temasında en az 15 dakika göz kapaklarının altında bol miktarda suyla durulayın ve hemen tıbbi yardım alın..
Cilt ile temasında derhal fırçalayın ve etkilenen bölgeyi suyla yıkayın. Tahriş devam ederse tıbbi yardım isteyin.
Suya verdiği reaksiyon nedeniyle yutulması halinde zararlıdır. Kusmaya neden olmayın. Derhal tıbbi yardım almalı ve kurbanı tıp merkezine götürmelisin..
Sodyum hidrürün yağ içinde dağılımı toz değildir. Bununla birlikte, reaksiyona giren malzeme ince bir kostik sis yayabilir. Solunması halinde, ağzınızı suyla çalkalayın ve kurbanı temiz hava olan bir yere nakledin. Tıbbi yardım alınmalıdır (Rhom and Hass Inc., 2007).
uygulamaları
Sodyum hidrürün ana kullanımı, bir karbanyonun (baz tarafından katalizlenerek) oluşmasıyla oluşan yoğuşma ve alkilasyon reaksiyonlarının gerçekleştirilmesidir..
Yağdaki sodyum hidrit, asetoasetik ester, Claisen, Stobbe, Dieckmann ve diğer ilgili reaksiyonlarda bir deprotonlama maddesi olarak işlev görebilme kabiliyetine sahip sodyum ve sodyum metal alkolatları andırır. Buradaki diğer yoğuşma maddelerine göre belirgin avantajları vardır:
- Daha doğrudan bir deprotonasyon ile sonuçlanan daha güçlü bir bazdır.
- Fazlalık gerekmez.
- Üretilen H2, reaksiyonun derecesinin bir ölçüsünü verir.
- İndirimler gibi ikincil reaksiyonlar ortadan kalkar.
2-aminopiridin ve fenotiyazin gibi aromatik ve heterosiklik aminlerin alkilasyonları, toluen-metilformamid karışımları kullanılarak yüksek verimle kolayca elde edilir. Dimetilformamid konsantrasyonu, reaksiyon hızını kontrol etmek için kullanılan bir değişkendir (HINCKLEY, 1957).
Yakıt hücresi araçlarında kullanım için hidrojenin depolanması için sodyum hidrit kullanımı önerilmiştir, hidrit hidrojeni serbest bırakmak için su varlığında ezilmiş plastik granüller içine alınır..
referanslar
- HINCKLEY, M.D. (1957). Sodyum Hidrit Üretimi, Kullanımı ve Kullanım Alanları. Kimyadaki Gelişmeler, Cilt 19, 106-117.
- Mark Winter [Sheffield Üniversitesi ve WebElements Ltd., U. (1993-2016). Sodyum: sodyum hidrit. WebElements'dan alındı: webelements.com.
- Ulusal Biyoteknoloji Bilgi Merkezi. (N.D.). PubChem Bileşik Veritabanı; CID = 24758. PubChem'den alındı: pubchem.ncbi.nlm.nih.gov.
- Rhom ve Hass inc. (2007, Aralık). Sodyum Hidrit Yağda% 60 Dispersiyon. Dow.com adresinden alındı.
- Kraliyet Kimya Derneği. (2015). Sodyum hidrit. ChemSpider'den: chemspider.com.
- SODYUM HİDRİD. (2016). Kameokimyasallardan elde edildi: cameochemicals.noaa.gov.
- Sodyum hidrit Formülü - Sodyum hidrit Kullanımları, Özellikleri, Yapısı ve Formülü. (2005-2017). Softschools.com'dan alındı: softschools.com.
- SODYUM HİDRİD. (N.D.). Chemicalland21 adresinden alındı: chemicalland21.com.
- Su ile reaksiyona girdiğinde neden katı sodyum hidrür bazlıdır ve asit değildir? (2016, 20 Nisan). Stackexchange'ten alındı: chemistry.stackexchange.com.


