Kalay Klorür (SnCl2) Özellikleri, Yapısı, Kullanımları ve Riskleri
kalay klorür (II) veya kalay klorür, SnCl'nin kimyasal formülü;2, beyaz kristalli bir katı bileşik, kalay reaksiyonunun ürünü ve konsantre bir hidroklorik asit çözeltisi: Sn (s) + 2HCl (conc) => SnCl2(aq) + H2(G). Sentezinin işlemi (hazırlanması) asitle reaksiyona girmesi için kalay dolgusu parçalarının eklenmesinden oluşur.
Kalay parçaları eklendikten sonra, inorganik tuz elde edilinceye kadar bir dehidrasyon ve kristalizasyon gerçekleştirilir. Bu bileşikte, kalay, klor atomları ile bağlar oluşturmak için değerlik kabuğundan iki elektron kaybetti.
Kalayın değerlik yapılandırması dikkate alınırsa bu daha iyi anlaşılabilir (5s25px2pve0pz0) elektrot çifti orbital p'yi işgal ettiğindex H protonlarına verilir+, diyatomik bir hidrojen molekülü oluşturmak için. Yani, bu redoks tipi bir reaksiyondur.
indeks
- 1 Fiziksel ve kimyasal özellikler
- 1.1 Valencia yapılandırması
- 1.2 Tepkime
- 1.3 İndirgeyici aktivite
- 2 Kimyasal yapı
- 3 Kullanım
- 4 Risk
- 5 Kaynakça
Fiziksel ve kimyasal özellikler
SnCl bağlantıları2 İyonik mi yoksa kovalent mi? Kalay (II) klorürün fiziksel özellikleri ilk seçeneği belirler. Bu bileşik için erime ve kaynama noktaları, zayıf moleküller arası etkileşimlerin, kovalent bileşiklerin ortak gerçeğinin göstergesi olan 247 ° C ve 623 ° C'dir..
Kristalleri beyazdır ve görünür spektrumda sıfır emilimine dönüşür.
Valencia yapılandırması
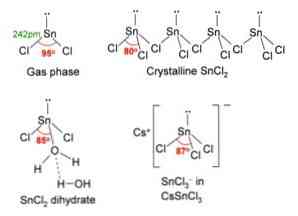
Yukarıdaki resimde, sol üst köşede, izole edilmiş bir SnCl molekülü gösterilmektedir2.
Merkezi atomun hibridizasyonu sp olduğundan moleküler geometri düz olmalıdır2 (3 yörünge sp2 ve kovalent bağlar oluşturmak için saf bir yörünge), ancak serbest elektron çifti hacmi kaplar ve klor atomlarını aşağı iterek moleküle açısal bir geometri verir.
Gaz fazında bu bileşik izole edilir, bu nedenle diğer moleküller ile etkileşime girmez.
Orbital p'deki elektron çiftinin kaybı olarakx, kalay iyon Sn'ye dönüşür2+ ve sonuçtaki elektronik konfigürasyonu 5 saniyedir.25px0pve0pz0, Diğer türlerin bağlantılarını kabul etmek için tüm p orbitalleriyle.
Cl iyonları- Sn iyonu ile koordinat2+ kalay klorüre neden olur. Bu tuzdaki kalayın elektronik konfigürasyonu 5 sn'dir.25px2pve2pz0, serbest yörüngesindeki bir başka elektron çiftini kabul edebilmekz.
Örneğin, başka bir Cl iyonunu kabul edebilirsiniz-, trigonal düzlem geometrisi kompleksi (üçgen tabanlı bir piramit) ve negatif yüklü [SnCl3]-.
reaktivite
SnCl2 değerlik oktetini tamamlamak için yüksek reaktiviteye ve Lewis asidi (elektron reseptörü) gibi davranma eğilimine sahiptir..
Tıpkı bir Cl iyonunu kabul ettiği gibi-, Aynısı, bir su molekülünü doğrudan kalayla bağlayarak kalay atomunu "hidratlayan" su ile olur ve ikinci bir su molekülü birinci ile hidrojen bağ etkileşimlerini oluşturur..
Bunun sonucu SnCl.2 saf değildir, fakat susuz tuzundaki su ile koordine edilir: SnCl2· 2H2Ey.
SnCl2 Suda ve polar çözücüler içinde çok çözünür, çünkü polar bir bileşiktir. Bununla birlikte, suda çözünebilirliği, kütle ağırlığından az, bir bazik ve çözünmez tuz üretmek için bir hidroliz reaksiyonunu (bir su molekülünün kopması) aktive eder:
SnCb2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HC1 (sulu)
Çift ok, HC1 konsantrasyonları artarsa sola (reaktiflere doğru) tercih edilen bir denge kurulduğunu gösterir. Bunun için SnCl çözümleri2 İstenmeyen tuz hidroliz ürününün çökelmesini önlemek için kullanılan bir asit pH'ına sahiptir..
İndirgeyici aktivite
Kalay (IV) klorür veya stannik klorür oluşturmak için havadaki oksijenle reaksiyona girer:
6 SnCl2(aq) + O2(g) + 2H20 (l) => 2SnCl4(sulu) + 4Sn (OH) Cl (s)
Bu reaksiyonda kalay, elektronegatif oksijen atomuyla bir bağ oluşturarak oksitlenir ve klor atomlarıyla bağ sayısını arttırır..
Genel olarak, halojenlerin (F, Cl, Br ve I) elektronegatif atomları Sn (IV) bileşiklerinin bağlarını stabilize eder ve bu durum SnCl'nin neden açıkladığını açıklar.2 bu bir indirgeyici maddedir.
Tüm değerlik elektronlarını oksitlediğinde ve kaybettiğinde, Sn iyonu4+ 5 s yapılandırma ile kalır05px0pve0pz0, Orbital 5'lerdeki elektron çifti olan "koparmak" en zoru.
Kimyasal yapısı
SnCl2 Dişlerin uçlarının klorür olduğu testerelerin sıralarına benzer şekilde ortofobik tipte bir kristal yapı sunar.
Her satır bir SnCl zinciridir3 başka bir Sn atomuyla bir Cl köprüsü oluşturma (Cl-Sn (Cl)2-Yukarıdaki resimde görüldüğü gibi Cl- ···). Sn-Cl tipinin zayıf etkileşimleriyle bağlanan iki zincir, kristalin katı tanımlanıncaya kadar, başka bir katman üzerinde üst üste bindirilen ve düzenlemenin bir katmanını oluşturur..
Serbest elektron çifti 5s2 yapıda bozulmaya neden olur çünkü hacmi kaplar (elektronik bulutun hacmi).
Sn, dokuz'a eşit bir koordinasyon numarasına sahip olabilir; bu, dokuz komşuya sahip olanla aynıdır, her birinin içinde bulunan diğer Cl'ye ek olarak, bu geometrik şeklin ortasına yerleştirilmiş olan bir trigonal prizma çizer. prizmanın kare yüzlerinin.
Bu, Sn (koyu gri küreler) yukarı bakacak bir zincir ve buna bağlı üç Cl'nin üçgen zemin oluştururken, üst üç üçgen üçgen çatıyı oluşturduğunu gözlemlemek daha kolaydır..
uygulamaları
Organik sentezde aromatik nitro bileşikleri için (Ar-NO) bir indirgeyici madde olarak kullanılır.2 à Ar-NH2). Kimyasal yapısı laminer olduğu için, organik reaksiyonların kataliz dünyasında kullanım bulur, bunun yanında katalitik destek için potansiyel bir aday olur.
İndirgeme özelliği, altın bileşiklerinin varlığını belirlemek, gümüş aynalarla bardakları kaplamak ve bir antioksidan görevi yapmak için kullanılır..
Ayrıca, moleküler geometrisinde trigonal piramit (: SnX3)- M+) çok sayıda bileşiğin (Pt küme kompleksi gibi) sentezi için Lewis bazı olarak kullanılır.3Sn8Cı20, elektron içermeyen çift Lewis asidiyle koordine edildiğinde).
riskler
SnCl2 Beyaz kan hücrelerine zarar verebilir. Aşındırıcı, tahriş edici, kanserojendir ve deniz ekosistemlerinde yaşayan türler üzerinde yüksek olumsuz etkileri vardır..
Zararlı klor gazı açığa çıkararak yüksek sıcaklıklarda ayrışabilir. Yüksek oksitleyici ajanlarla temas ettiğinde, patlayıcı reaksiyonları tetikler..
referanslar
- Shiver ve Atkins. (2008). İnorganik kimya içinde Grup 14'ün unsurları (dördüncü baskı, sayfa 329). Mc Graw Hill.
- ChemicalBook. (2017). ChemicalBook'tan 21 Mart 2018 tarihinde alındı: chemicalbook.com
- Pubchem. (2018). Kalay Klorür PubChem'den 21 Mart 2018'de alındı: pubchem.ncbi.nlm.nih.gov
- Vikipedi. (2017). Kalay (II) klorür. 21 Mart 2018'de Wikipedia'dan alındı: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Germanyum Kimyası: Kalay ve Kurşun (ilk basım). p-82,83. Pergamom Press.
- F. Hulliger. (1976). Katman Tipi Fazların Yapısal Kimyası. P-120,121. D. Reidel Yayın Şirketi.



