Kinyoun boyama vakfı ve teknikleri
Kinyoun boyama Aside dirençli bakterileri ve asit parazitlerini lekelemek için kullanılan bir renklendirme tekniğidir. Ziehl-Neelsen'in renklendirmesinin modifikasyonundan doğdu; Her iki teknik de aynı şekilde yorumlanır, ancak iki unsurda farklılık gösterir: ana reaktifin hazırlanmasında ve Kinyoun tekniğinin ısı kullanmaması.
Bu nedenle soğuk modifiye Ziehl-Neelsen veya Kinyoun soğuk boyama olarak da bilinir. Renklendirmesi için endikedir Mycobacterium tuberculosis, Mycobacterium leprae, atipik mikobakteriler, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris ve Cyclosporas cayetanensis.
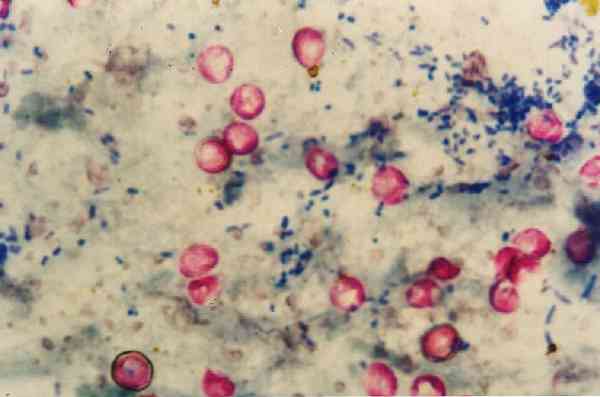
Kısmen aside dirençli alkol oldukları için Nocardias'ın bu teknikle zayıf boyanmasından bahsetmekte fayda var, bu nedenle bu tür için metodolojide bir değişiklik var..
Sırasıyla, Kinyoun soğuk tekniği, Didier tarafından coccidia'nın tespiti için modifiye edilmiş trikrome tekniği ile birleştirildi (Cryptosporidium parvum ve İzospora belli) ve microsporidia sporları (Enterocytozoon bieneusi ve Ensefalitozoon intestinalis).
indeks
- 1 Vakfı
- 2 Tekniği
- 2.1 Malzemeler
- 2.2 Kinyoun füme fuşsin hazırlanması
- 2.3 Alkol asidinin hazırlanması
- 2.4 Metilen mavisi kontrast boya hazırlanması
- 2.5 Kinyoun boyama tekniği
- 2.6 Nocardias İçin Özel Kinyoun Tekniği
- 2.7 Didier tarafından modifiye edilmiş fenolik ve trikromik fuşsin kombine tekniği
- 2.8 Kalite kontrol
- Ziehl tekniği ile karşılaştırıldığında 3 Kinyoun tekniği -Neelsen
- 4 Referans
vakıf
Ana boyama reaktifi, balmumu hücre çeperi içinde mevcut olan, mikobakterilerin ve bazı parazitlerin lipidleri (mikolik asitler) bakımından zengin olan balbol hücre duvarı içinde mevcut olan karbolik asitlere bağlanma özelliğine sahip olan karbol fuchsin veya fuchsin fenicada'dır..
Bu birleşme, asitin renginin giderilmesiyle telafi edilmez; bu nedenle, mikroorganizmalar aside dayanıklı alkol olarak tanımlanır.
Boyayı ısıyla sabitleyen Ziehl-Neelsen tekniğinin aksine, Kinyoun tekniğinde bu adım gerekli değildir, çünkü bu teknik için hazırlanan fenolik fuchsin çözeltisi yüksek miktarda fenol içerir..
Fenol, carbol fuchsin boyasının girişine izin veren hücre duvarının lipid malzemesini çözer. Boya nüfuz ettikten sonra, alkol-asitli yıkamaya rağmen sabit kalır.
Bu şekilde, aside dayanıklı mikroorganizmalar, karakteristik kırmızı rengini alırken, aside dayanıklı alkol olmayan her şey renksizleşir ve mavi renk alır..
teknik
malzemeler
- Modifiye fenolik fuşsin.
- Alkol asetik.
- Metilen mavisi.
Kinyoun destekli fuchsin hazırlanması
- Bazik fuşsin: 4 gr.
- Fenol: 8 ml.
- Alkol (% 95): 20 ml.
- Damıtılmış su: 100 ml.
Alkoldeki bazik fuchsin yavaşça çözülmeli ve sürekli karıştırılmalıdır. Daha sonra, kristalize fenol, 56 ° C'de bir su banyosunda eritilir. Çözündükten sonra, yukarıda hazırlanan fuşsin çözeltisine 8 ml ekleyin..
Alkol asidi hazırlanması
- Konsantre hidroklorik asit: 3 ml.
- Etanol (% 95): 97 ml.
Ölçülmeli, birleştirilmeli ve karıştırılmalıdır.
Metilen mavisi kontrast boya hazırlanması
- Metilen mavisi: 0.3 g.
- Damıtılmış su: 100 ml.
Tartılır ve çözülür.
Kinyoun boyama tekniği
1- Balgam, pulmoner sıvı, idrar sedimenti, beyin omurilik sıvısı veya dışkı olabilecek numuneden doğrudan smear hazırlayın; veya birincil kültür ortamında geliştirilen saf kolonilerden elde edilen bir mikroorganizma süspansiyonundan.
2- Smear'ı ısı ile sabitleyin.
3- Lekeyi boyama köprüsüne yerleştirin ve Kinyoun'un hazırlanmış fenolik fuşsin reaktifi ile örtün. 3 ya da 5 dakika bekletin.
4- Damıtılmış suyla yıkayın.
5- Asit alkol ile 3 dakika boyunca ağartın ve tekrar distile suyla yıkayın.
6- Artık boya sürüklenene kadar asit alkolle 1 veya 2 dakika boyunca ağartın..
7- Distile su ile yıkayın ve suyunu dik konuma getirerek süzün.
8- Hazırlanmayı metilen mavisi ile örtün ve 4 dakika bekleyin..
9- Distile su ile yıkayınız ve kurumaya bırakınız.
10- 40X'de ve sonra 100X'de inceleyin.
Aside dirençli mikroorganizmaların boyanmasını iyileştirmek ve hızlandırmak istiyorsanız, 30 veya 40 ml Kinyoun fenolik fuchsin'e 1 damla ıslatma maddesi (tergitol No. 7 gibi) ekleyin..
Bazı laboratuvarlar parlak yeşil veya pikrik asit için metilen mavisi kontrast boyayı değiştirir; ilki arka plana yeşil bir renk verir, ikincisi sarı bir renk verir.
Nocardi'lere özel Kinyoun tekniği
Nocardia bakterilerinin boyanmasını iyileştirmek için Kinyoun boyamasının bir modifikasyonu kullanılır. Teknik aşağıdaki gibidir:
1- Smeayı 3 dakika boyunca Kinyoun füme fuşsinle kapatınız..
2- Distile suyla yıkayın.
3- Artık boya tutulana kadar% 3 oranında hazırlanmış asit alkollü kısa beyazlatıcı.
4- Tekrar distile su ile yıkayınız..
5- Hazırlanmayı metilen mavisi ile kapatın ve 30 saniye bekleyin.
6- Distile su ile yıkayınız ve kurumaya bırakınız..
Didier tarafından modifiye edilmiş fenolik ve trikromik fuşsin kombine tekniği
Bu teknik, coccidia ve sporların aranmasında dışkı örneklerinin analizi için önerilmektedir. Microsporidium sp aynı zamanda İzlenecek prosedür aşağıdaki gibidir:
1- Smear'i 10 dakika boyunca Kinyoun phenolic fuchsin ile örtün.
2- Boyayı çıkarın ve distile suyla yıkayın.
3- Alkol hidroklorik asit ile 30 saniye boyunca ağartıcı.
4- Tekrar distile su ile yıkayınız..
5- Smear'ı 37 ° C'de 30 dakika trikrom çözeltisi ile örtün.
6- Damıtılmış suyla yıkayın.
7-Alkol asetik asit ile 10 saniye boyunca renklendirin.
8- Smear'ı% 95 etanol kullanarak 30 saniye yıkayın.
Kalite kontrol
Pozitif kontrol olarak, smear'lerin suşları ile hazırlanır. Mycobacterium tuberculosis ve bakterilerin doğru rengi aldığını doğrulamak için hazırlanan reaktiflerle lekelenmiştir (kırmızı-fuşya).
Negatif kontroller, aside dirençli alkole sahip olmayan herhangi bir suşu ile lekeler hazırlayarak da kullanılabilir, böylece tüm numunenin kontrast rengini aldığını doğrulayın.
Ziehl tekniği ile karşılaştırıldığında Kinyoun tekniği -Neelsen
Kinyoun tekniği daha basittir çünkü ısıtma basamağını ortadan kaldırır, ancak asıl avantajı buhar salınımını önler, yüksek derecede toksiktir ve uzun vadede kansere neden olmasıdır. Bu nedenle, Kinyoun boyama personeli boyama için daha güvenlidir.
Aşındırıcı ve ağartıcı yanıcı olduğu için, reaktiflerin ciltle doğrudan temas etmemesine dikkat etmek gerektiğinin dikkate alınması önemlidir..
Dezavantajlarla ilgili olarak, negatif bir lekelenme, mikroorganizmanın mevcut olmadığını göstermez. Ek olarak, hücre detritusunun varlığı tanıda karışıklık yaratan yanlış pozitiflere neden olabilir.
referans
- Uygulamalı Klinik Kimya (2016). BK Kinyoun Kit., Cromakit.es adresinde mevcuttur.
- Orozco-Rico Miguel. HIV'de Kinyoun boyaması ve iki Coccidia. Tıp Dergisi MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott'un mikrobiyolojik tanısı. 12 ed. Arjantin. Panamericana S.A Editörden.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiyolojik tanı (5. basım). Arjantin, Editör Panamericana S.A..
- Wikipedia katılımcıları. "Kinyoun boyası." Vikipedi, Özgür Ansiklopedi. Wikipedia, Özgür Ansiklopedi, 8 Şubat 2018. Web. 5 Ocak 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Coccidia ve Microsporidia'nın eş zamanlı teşhisi için bir renklendirme tekniğinin uygulanması. Cumhuriyet Üniversitesi Hijyen Enstitüsü. Montevideo. Uruguay. Erişim: higiene.edu.uy


