Giemsa boyama vakfı, malzemeleri, tekniği ve kullanımları
Giemsa lekesi asit ve bazik boyaların karışımına dayanan klinik örneklerin boyanması türüdür. Yaratılışı Romanowsky’nin yaptığı çalışmalardan ilham aldı, Almanya’daki kimyager ve bakteriyolog Gustav Giemsa’nın bileşikleri stabilize etmek için gliserol ekleyerek mükemmelleştirdi..
Romanowsky'nin orjinal tekniğine getirilen değişiklikler, mikroskobik gözlemleri büyük ölçüde iyileştirdi, bu yüzden bu teknik Giemsa boyası adıyla vaftiz edildi..
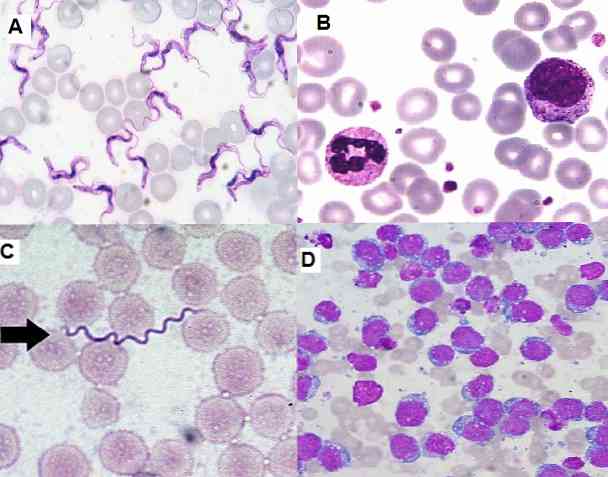
Son derece işlevsel ve ekonomik olan basit bir teknik olduğundan, klinik laboratuvarda hematolojik bulaşmalar, kemik iliği örnekleri ve doku kesitleri için yaygın olarak kullanılmaktadır..
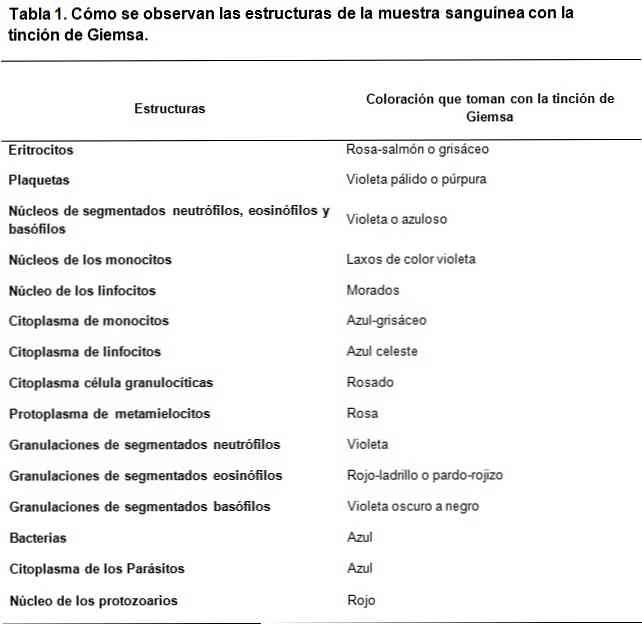
Giemsa boyama tekniği, hücrelerin spesifik yapılarının gözlenmesini sağladığı için sitolojik çalışmalar için çok kullanışlıdır. Bu teknik, ince kromatin izlerini bile ayırt edebilen sitoplazmaları, çekirdekleri, nükleolleri, vakuolleri ve hücrelerin granüllerini lekeler..
Ek olarak, çekirdeğin büyüklüğünde, biçiminde veya renklenmesinde önemli değişiklikler tespit edilebilir, burada çekirdek-sitoplazma ilişkisinin kaybının görselleştirilmesi mümkündür.
Öte yandan, kemik iliği ve periferik kandaki olgunlaşmamış hücrelerin, lösemi gibi ciddi hastalıkların teşhisi için önemli olduğunu belirlemeye izin verir. Hemoparazitleri, ekstra ve hücre içi bakterileri, mantarları, diğerleri arasında tespit etmek de mümkündür..
Sitogenetikte oldukça kullanılır, çünkü hücrelerin mitozlarını incelemek mümkündür..
indeks
- 1 Giemsa renklendirme Vakfı
- 2 Malzemeler
- 2.1 Ana çözeltinin hazırlanmasına yönelik malzemeler
- 2.2 Ana çözeltinin hazırlanma modu
- 2.3 Tampon çözeltisini hazırlayan malzemeler
- 2.4 Boyanın nihai hazırlanması
- 2.5 Renklendirmeyi gerçekleştirmek için gereken ek malzemeler
- 3 Tekniği
- 3.1 Boyama işlemi
- 4 Yardımcı programlar
- 4.1 Hematoloji
- 4.2 Mikoloji
- 4.3 Bakteriyoloji
- 4.4 Parazitoloji
- 4.5 Sitoloji
- 4.6 Sitogenetik
- 5 Giemsa boyamasının etkinliğini gösteren araştırma
- 6 İyi boyama için öneriler
- 7 Giemsa'nın boyanmasında sık görülen hatalar
- 7.1 Son derece mavi renklendirme
- 7.2 Aşırı pembe renklendirme
- 7.3 Smearde çökelti varlığı
- 7.4 Morfolojik eserlerin varlığı
- 8 Depolama modu
- 9 Kaynaklar
Giemsa renklendirmesinin temeli
Romanowsky tipi boyalar, bazik ve asit yapılarının lekelenmesini sağlamak için asit ve bazik boyalar arasında bir kontrast kullanılmasına dayanır. Görülebildiği gibi, bazik yapıları boyamak için asit boyalarının bir afinitesi vardır;.
Kullanılan bazik boya metilen mavisi ve oksitlenmiş türevleridir (Azure A ve Azure B), asit boya ise eozin.
Hücrelerin asit yapıları, nükleik asitlerdir, bölümlenmiş bazofillerin granülleri, diğerleri arasında, bu nedenle metilen mavisi ile boyanırlar..
Bu anlamda, hücrelerin temel yapıları hemoglobin ve diğerleri arasında bölümlenmiş eozinofillerde bulunanlar gibi bazı granüllerdir; bunlar eozin ile boyanacak.
Öte yandan, metilen mavisi ve masmavi'nin metakromatik boyalarla nitelendirilmesi nedeniyle, sahip oldukları polianyonların yüküne göre farklı yapılara değişken bir ton sağlayabilirler..
Bu, bazik ve asit boyaların stratejik kombinasyonunun, asidik yapılar durumunda soluk mavi, koyu mavi, lila ve mor tonlarda yürürken, her bir yapının biyokimyasal özelliklerine göre geniş bir renk yelpazesi geliştirebilmesini sağlar..
Eozin tarafından sağlanan renklendirme daha stabil iken, kırmızımsı-turuncu ve somon arasında renk üretme.
malzemeler
Ana çözeltinin hazırlanması için malzemeler
Stok çözeltisinin hazırlanması, 500 cc aseton içermeyen metil alkol ve 50 cc nötr gliserin ölçen 600 mg toz Giemsa boyasının tartılmasını gerektirir.
Ana çözelti hazırlama modu
Ağır Giemsa tozunu bir harç içine koyun. Topaklar varsa, püskürtülmeleri gerekir. Daha sonra, ölçülen gliserin miktarını hatırlayın ve çok iyi karıştırın. Elde edilen karışım çok temiz bir amber şişeye dökülür.
Gliserin geri kalanı harca yerleştirilir. Harcın duvarlarına sıkışmış kalan boyayı temizlemek için tekrar karıştırın ve aynı şişeye dökün.
Şişe 55 ° C'de bir su banyosunda 2 saat boyunca örtülür ve taşınır. Benmari banyosundayken karışımı her yarım saatte bir hafifçe karıştırın.
Daha sonra, karışım alkol yerleştirmek için soğumaya bırakılır. Önceden, ölçülen alkolün bir kısmı, boyadan geriye kalanların yıkanmasını bitirmek için harca yerleştirilir ve daha sonra alkolün geri kalanıyla birlikte karışıma eklenir..
Bu hazırlık, en az 2 hafta boyunca olgunlaşmaya bırakılmalıdır. Ana çözeltinin kullanılan kısmı filtrelenmeli.
Preparatın kontaminasyonunu önlemek için, sürekli kullanımda olan kısmın damlalıklı küçük bir kehribar şişesine geçirilmesi önerilir. Reaktif her bittiğinde şarj edin.
Tampon çözeltisini hazırlamak için malzemeler
Diğer taraftan, pH 7.2'de bir tampon çözelti aşağıdaki gibi hazırlanır:
6.77 gram sodyum fosfat (susuz) tartılır (NaHPO4), 2.59 g potasyum dihidrojen fosfat (KH)2PO4) ve 1000 cc'ye kadar damıtılmış su.
Boyanın nihai hazırlanması
Nihai boyama çözeltisinin hazırlanması için, 2 cc filtre edilmiş stok çözeltiden ölçülür ve 6 cc tampon çözeltisi ile karıştırılır. Karışım karıştırıldı.
Dikkate alınması gereken önemli bir husus, boya hazırlama tekniklerinin ticari eve göre değişebileceğidir..
Renklendirmeyi gerçekleştirmek için gereken ek malzemeler
Tarif edilen materyallerin yanı sıra, renkli köprüler, su perdeleri veya yıkama için tampon, nesneler veya kapaklar için tabakalar, renklenme zamanlarını kontrol etmek için kronometre ve kurutma kağıdı veya kurutmak için kullanılabilecek bazı malzemeler kullanılmalıdır ( gazlı bez veya pamuk).
teknik
Boyama işlemi
1) Renklendirmeden önce, numunenin temiz bir slayt üzerine yayılması gerekir..
Örnekler kan, kemik iliği, histolojik dokuların kesilmesi veya serviko-vajinal örnekler olabilir. Dış yüzeylerin ince olması ve renklendirilmeden önce 1 veya 2 saat kurumaya bırakılması önerilir..
2) Renklendirmeniz gereken tüm sayfalar renkli bir köprüye yerleştirilir. Her zaman aynı sırada çalışın ve her sayfayı iyi tanımlayın.
3) Smear üzerine birkaç damla% 100 metil alkol (metanol) yerleştirin ve numuneyi sabitlemek ve kurutmak için 3 ila 5 dakika bekletin.
4) Tabakadaki metanolü atın ve kurumaya bırakın.
5) Kuruduktan sonra, son boyama çözeltisini, tüm tabaka kaplanana kadar bir damlalık ile yerleştirin. 15 dakika bekletin. Bazı yazarlar 25 dakikaya kadar tavsiye eder. Ticari eve bağlı.
6) Boyayı boşaltın ve lekeyi saf suyla veya 7.2 tampon çözeltisiyle yıkayın..
7) Lekeli bir kağıt üzerinde, yaprakların bir destek yardımı ile dikey olarak düzenlenmiş açık havada kurumasını sağlayın.
8) Kalan boyayı gidermek için lamın arkasını alkolle ıslatılmış gazlı bez veya pamuklu çubukla silin..
kamu hizmetleri
Giemsa boyama tekniği aşağıdakiler de dahil olmak üzere çeşitli alanlarda kullanılır: hematoloji, mikoloji, bakteriyoloji, parazitoloji, sitoloji ve sitogenetik.
hematoloji
Bu boyamaya verilen en sık kullanılan yardımcıdır. Bununla beraber, kemik iliği veya periferik kan örneklerinde bulunan hücrelerin her birini tanımlayabiliriz. Her serinin sayısını tahmin etmenin yanı sıra, lökositoz veya lökopeni, trombositopeni vb..
Olgunlaşmamış hücreleri tanımlamaya duyarlı olduğu için, akut veya kronik lösemilerin tanısında önemlidir. Diğerleri arasında orak hücre hastalığı, orak hücre hastalığı gibi anemi tanısı koymak da mümkündür..
mantarbilim
Bu alanda arama yapmak için kullanmak yaygındır. Histoplazma capsulatum (hücre içi dimorfik mantar) doku örneklerinde.
bakteriyoloji
Giemsa ile boyanmış hematolojik smearlerde tespit etmek mümkündür Borrelias sp hastalığı olan hastalarda ateş recurrentis denir. Spiroketler ateşli zirvede alınan örneklerde eritrositler arasında bol miktarda bulunur..
Hücre içi bakterileri olduğu gibi görselleştirmek de mümkündür Rickettsias sp ve Chlamydia trachomatis enfekte olmuş hücrelerde.
parazitoloji
Parazitoloji alanında, Giemsa boyaması, sıtma, Chagas hastalığı ve leishmaniasis gibi paraziter hastalıkların teşhisini sağlamıştır..
İlk ikisinde parazitler Plasmodium sp ve Trypanosoma cruzi sırasıyla enfekte olmuş hastaların periferik kanlarında görselleştirilebilirler, hastalığın hangi fazda olduğuna göre farklı evrelerde bulunabilirler..
Kan parazitlerinin araştırılmasını geliştirmek için, May-Grünwald boyası ile karıştırılmış Giemsa boyası kullanılması tavsiye edilir..
Aynı şekilde, parazitlerin bulunduğu Giemsa ile boyanmış cilt biyopsisi örneklerini değerlendirirken kutanöz leishmaniasis teşhisi konulabilir.
sitoloji
Giemsa boyaması, endoservikal numunelerin sitolojik incelemesinde de kullanılır, ancak bu amaç için en sık kullanılan teknik değildir..
Ancak, kaynak kıtlığı durumlarında, Papanicolaou tekniği tarafından sunulana benzer bir işlevselliğe sahip ve daha düşük bir maliyetle kullanılabilir. Ancak, sınav görevlisi için uzmanlık gerektirir.
sitogenetik
Giemsa boyamasının ilgili bir özelliği, DNA adeninleri ve timinleri bakımından zengin bölgelere güçlü bir şekilde bağlanabilmesidir. Bu, DNA'nın, hücrelerin mitozları sırasında, farklı yoğuşma durumlarında görünmesini sağlar.
Bu çalışmalar, kromozomların farklı bölgelerinin kopyaları, silinmesi veya yer değiştirmesi gibi renk sapmalarını tespit etmek için gereklidir..
Giemsa boyamasının etkinliğini gösteren araştırma
Cannova ve arkadaşları (2016), kutanöz leishmaniasis tanısı için 3 renklendirme tekniğini karşılaştırmıştır..
Bunun için deney hayvanlarından elde edilen örnekleri kullandılar (Mesocrisetus hava durumu) Leishmanias ile deneysel olarak aşılanmış.
Yazarlar Giemsa boyamasının Pap-mart® ve Gaffney boyamasından daha iyi olduğunu göstermiştir. Bu nedenle, Giemsa boyasının kutanöz leishmaniasis teşhisi için ideal olduğunu düşündüler..
Yazarlar tarafından elde edilen mükemmel sonuçlar, Giemsa karışımını oluşturan boyaların kombinasyonunun, amastigot yapılarının hem intra hem de hücre dışı olarak açıkça ayırt edilmesine izin veren uygun bir kontrast oluşturmak için gerekli koşulları sağlaması gerçeğinden kaynaklanmaktadır..
Diğer teknikler (Pap-mart® ve Gaffney) de yaptı, ancak daha zayıf bir şekilde ve dolayısıyla görselleştirmeleri daha zor. Bu nedenle Giemsa boyaması, leishmaniasis'in parazitolojik tanısı için önerilmektedir..
Aynı şekilde, Ramírez ve arkadaşlarının (1994) yaptığı bir çalışma, konjonktival smearlerde Giemsa ve Lendrum lekelerinin geçerliliğini değerlendirdi. Chlamydia trachomatis.
Yazarlar, Giemsa ve Ledrum boyamasının aynı özelliğe sahip olduğunu belirledi, ancak Giemsa daha duyarlıydı..
Bu, günümüzde Giemsa boyamasının neden klamidya enfeksiyonlarının teşhisinde en sık kullanıldığını, özellikle de az miktarda kaynak bulunduğunu açıklamaktadır..
İyi boyama için öneriler
Yaprakların kuruması hızlandırılmamalıdır. İhtiyati zaman açık havada kurutmak için beklenmelidir. Yaklaşık 2 saat.
En iyi sonuçlar için hemen 2 saat sonra renklendirin.
Lekelerin daha iyi sabitlenip lekelenmeleri için, örnek tabakaya ince ve düzgün bir tabaka kalacak şekilde dağıtılmalıdır..
Tercih edilen kan numunesi kılcaldır, çünkü smear doğrudan kan damlasından yapılır ve bu nedenle numune, hücre yapılarının bakımını destekleyen hiçbir katkı maddesi içermez..
Bununla birlikte, venöz kan kullanılıyorsa, EDTA antikoagülan olarak kullanılmalı ve heparin kullanılmamalıdır, çünkü bu hücreler genellikle hücreleri deforme eder.
Giemsa'nın boyanmasında sık rastlanan hatalar
Bu renklendirme uygulamasında hatalar yapılabilir. Yapıların gölgelerindeki ani değişimlerle kanıtlanırlar..
Son derece mavi boyama
Şunlar nedeniyle olabilir:
- Çok kalın lekeler
- Boyama süresinin aşılması
- Çok az yıkama.
- Nötr pH'ın (alkalin) üstünde reaktiflerin kullanımı.
Bu koşullar altında, aşağıdaki yapıların renkleri bozulmakta, böylece, pembe somon yerine eritrositler yeşil görünecek, kırmızı tuğla boyanması gereken eozinofillerin granülleri maviye veya griye dönecek ve böylece normal tonlardaki sapma.
Aşırı pembe renklenme
Şunlar nedeniyle olabilir:
- Yetersiz boyama süresi.
- Uzun süreli veya aşırı yıkama.
- Kötü kurutma.
- Çok asit reaktiflerin kullanımı.
Bu özel durumda, normalde mavi lekeli yapılar hemen hemen görünmezken, pembe lekeli yapılar çok abartılı tonlara sahip olacaktır..
Örnek: eritrositler parlak kırmızı veya koyu turuncu bir renk alacaktır, nükleer kromatin soluk pembe görünecek ve eozinofillerin granülleri parlak kırmızı olacaktır..
Smear içinde çökelti varlığı
Nedenleri olabilir:
- Kirli veya kötü yıkanmış çarşaf kullanın.
- Lekenin kurumasına izin vermeyin.
- Sabitleme çözümünü çok uzun süre bırakın.
- Lekeleme sonunda yetersiz yıkama.
- Kullanılan boyanın filtrasyonu yetersiz veya filtrasyonu.
Morfolojik eserlerin varlığı
Morfolojik eserler smearlarda görünerek mevcut yapıların görselleştirilmesini ve yorumlanmasını zorlaştırabilir. Bunun nedeni şudur:
- Heparin gibi kullanılan antikoagülan tipi.
- Kirli, hasarlı veya yağlı tabakaların kullanılması.
Depolama modu
Hazırlıktan sonra, boyanın çökmesini önlemek için boya oda sıcaklığında (15 - 25 ° C) tutulmalıdır. Kapalı amber bir kapta saklanmalıdır.
referanslar
- Cannova D, Brito E ve Simons M. Kutanöz Layşmanyazis tanısında renklendirme tekniklerinin değerlendirilmesi. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW Reaktifleri. Giemsa lekesi. Sürüm 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, İspanya.
- Clark G. Boyama prosedürleri (1981), 4 dökülmüş. Williams ve Willkins.
- Uygulamalı Klinik Kimya Tanı için Giemsa boya in vitro. Dağıtıcı: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F ve Grazioso C. Konjonktival smearlerde Giemsa ve Lendrum lekelerinin geçerliliği Chlamydia trachomatis. Sanit Panam Bol. 1994; 116 (3): 212-216.
- Casas-Rincon G. Genel Mikoloji. 1994. 2. Baskı, Universidad Central de Venezuela, Kütüphane baskıları. Venezuela, Caracas.
- "Giemsa lekesi." Vikipedi, özgür ansiklopedi. 1 Eyl 2017, 01:02 UTC. 6 Aralık 2018, en.wikipedia.org.


