Spor boyama temelleri, teknikleri ve kullanım alanları
spor boyama elverişsiz koşullarda bazı bakteri türlerini oluşturan direnç yapılarını renklendirmek için kullanılan metodolojidir; bu yapılar bir hayatta kalma şekline tekabül eder.
Spor oluşturan birçok cins vardır; Ancak, ana olanlar Bacillus ve Clostridium'dur. Bu cinsler, insanlar için patojenik türlere sahip oldukları için daha ilgili kabul edilir..
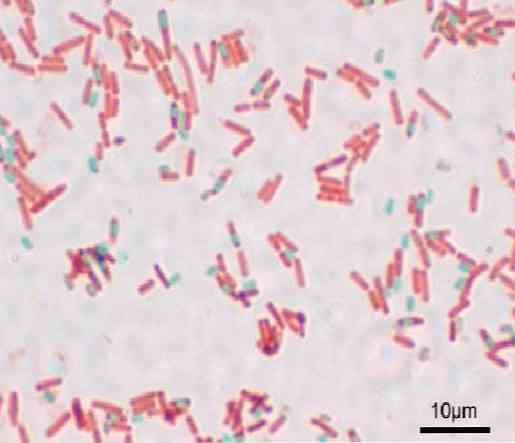
Her basil bir spora yol açabilir. Hazırlamanın boyandığı sırada, spor basili (endospor) içinde veya dışında (exospor) bulunabilir. Bakteriler için geleneksel boyama teknikleriyle - Gram boyası gibi - sporlar renksiz kalır.
Şu anda, onu boyamak için sporun kalın yapısını geçebilen birçok renklendirme metodolojisi vardır. Bu metodolojiler çok çeşitlidir; bunlar arasında Dorner tekniği, Möeller boyası ve Wirtz-Conklin olarak da bilinen Shaeffer-Fulton metodolojisinden söz edilebilir..
Bahsedilen tüm teknikler arasında, Shaeffer-Fulton metodolojisi rutin laboratuvarlarda en çok kullanılanıdır. Adını, 1930'da renklendirmeyi yaratan iki mikrobiyoloğa borçlu: Alicia Shaeffer ve MacDonald Fulton. Ancak, bazen teknik 1900'lerin iki bakteriyolog onuruna Wirtz-Conklin denir.
indeks
- 1 Vakfı
- 2 Spor boyama tekniği
- 2.1 Dorner tekniği
- 2.2 Modifiye Dorner tekniği
- 2.3 Shaeffer-Fulton veya Wirtz-Conklin Tekniği
- 2.4 Möeller tekniği
- 2.5 Isı olmadan Modifiye Möeller tekniği
- 3 Kullanım
- 3.1 Örnekler
- 4 Kaynakça
vakıf
Sporlar geleneksel renklerle lekelenmez çünkü çok kalın bir duvarları vardır. Sporların karmaşık bileşimi çoğu boya girişini engeller.
Sporlar dışarıdan içeriye doğru incelendiğinde, aşağıdaki tabakalar gözlenir: ilk olarak, glikoproteinlerin oluşturduğu en ince dış tabaka olan exosporium..
Sonra yüksek sıcaklıklara direnç sağlayan kütikül gelir, ardından peptidoglikandan oluşan korteks izlenir. Sonra protoplastı koruyan tabanın duvarı var.
Spor,% 15 oranında kalsiyum ve dipikolinik asit içeren kurutulmuş bir yapıdır. Bu nedenle, çoğu spor renklendirme tekniği, boyanın kalın yapıya nüfuz edebilmesi için ısı uygulamasına dayanır..
Spor boyandıktan sonra boyayı ortadan kaldıramaz. Shaeffer-Fulton tekniğinde, malakit yeşili vejetatif hücrelere girer ve ısının uygulanması üzerine endospor ve ayrıca exosporlara nüfuz eder..
Suyla yıkarken, boya bitkisel hücreden uzaklaştırılır. Bu, yeşil malakit boyasının hafif bazik olması nedeniyle oluşur ve bu nedenle vejetatif hücreye zayıf bir şekilde bağlanır..
Öte yandan, spordan çıkamaz ve nihayet safraninli basil kontrastıdır. Bu temel, benzer bir şeyin gerçekleştiği tekniklerin geri kalanı için geçerlidir..
Spor boyama teknikleri
Sporların lekelenmesini sağlamak için, incelemek istediğiniz şüpheli türün saf bir kültürüne sahip olmalısınız..
Kültür, mikroorganizmayı sporüle etmeye teşvik etmek için 24 saat boyunca aşırı sıcaklıklara maruz bırakılır. Bunun için kültür, 44 ° C'de bir fırına veya 24 veya 48 saat boyunca bir buzdolabına (8 ° C) yerleştirilebilir..
Belirtilen sıcaklıklarda çok fazla zaman kalırsa, tüm endosporlar basili terk edeceğinden sadece exosporlar gözlenecektir..
Sürenin sonunda, temiz bir slayt üzerine birkaç damla steril fizyolojik çözelti konmalıdır. Daha sonra mahsulün küçük bir kısmı alınır ve ince bir yayılır..
Daha sonra kurumaya bırakılır, ısıya sabitlenir ve aşağıda açıklanan bazı tekniklerle lekelenir:
Dorner tekniği
1- Bir test tüpünde damıtılmış su içindeki sporlu mikroorganizmanın konsantre bir süspansiyonunu hazırlayın ve eşit miktarda filtrelenmiş Kinyoun fenolik fuchsin ekleyin.
2- Boruyu 5 ila 10 dakika kaynar su içeren bir banyoya yerleştirin..
3- Temiz bir slayt üzerinde, önceki süspansiyondan bir damlayı% 10 nigrosin sulu solüsyon damlasıyla karıştırın, kaynatın ve süzün.
4- Hafif ısı ile hızlıca genişletin ve kurulayın.
5- 100X hedefi ile inceleyin (daldırma).
Sporlar kırmızılaşır ve bakteriyel hücreler koyu gri bir arka plana karşı neredeyse renksiz görünür.
Modifiye Dorner tekniği
1- Sporüle edilmiş mikroorganizmanın bir süspansiyonu bir sürgün üzerine yayılır ve ısıya sabitlenir.
2- Örnek, fenik asit fuşsin eklenmiş bir filtre kağıdı şeridi ile kaplanır. Boya, buhar salınımı oluşana kadar Bunsen bekiğin alevi ile 5-7 dakika ısıtılır. Sonra kağıt çıkarıldı.
3- Hazırlığı suyla yıkayın ve emici kağıtla kurulayın.
4- Smear'ı, nigrosini veya bir iğneyi yaymak için ikinci bir lam kullanarak,% 10 nigrosin içeren ince bir film ile kaplayın..
Sporlar ve bakteriler tarafından alınan renklendirme, önceki teknikte tarif edilenle aynıdır..
Shaeffer-Fulton veya Wirtz-Conklin tekniği
1- Slaytta sporlu mikroorganizma süspansiyonu ile ince bir yayılım yapın ve ısıya sabitleyin.
2- Slaydı% 5'lik malakit yeşili sulu bir çözelti ile örtün (bir filtre kağıdı tabakaya yerleştirilebilir).
3- Bunsen brülörünün alevi üzerinde ısınmak için buharın çıkmasına ve alevi çıkarmasına neden olun. İşlemi 6 ila 10 dakika tekrarlayın. İşlem sırasında malakit yeşili çözelti çok fazla buharlaşırsa, daha fazlası eklenebilir.
4- Filtre kağıdını çıkarın (yerleştirilmişse) ve suyla yıkayın.
5- Slaytı 30 saniye boyunca% 0,5 sulu safranin ile kapatın (tekniğin bazı varyantları% 0,1 sulu safranin kullanın ve 3 dakika bırakın).
Bu teknikle sporlar yeşil, basiller kırmızıdır.
Genç kültürlerin endosporlarının, çok net ve renksiz göründüklerinden dolayı iyi lekelenmemelerinin dezavantajı vardır. Bunu önlemek için, 48 saatlik inkübasyon kültürü kullanılması önerilir..
Möeller tekniği
1- Smear'i 2 dakika boyunca kloroform ile örtün.
2- Kloroformu atın.
3- 5 dakika boyunca% 5 kromik asit ile örtün.
4- Damıtılmış suyla yıkayın
5- Yaprak fuchsin-fenolik sazan ile kaplanmıştır ve buhar salınımına kadar Bunsen brülörünün alevine maruz kalmaktadır; daha sonra birkaç dakika alevden çıkarılır. İşlem 10 dakikaya kadar tekrar edilir..
6- Suyla yıkayın.
7- Çözmek için asitleştirilmiş etanol (hidroklorik alkol) kullanın. 20 veya 30 saniye bekletilir.
8- Distile su ile yıkayınız..
9- Tabakayı metilen mavisi ile kaplayan 5 dakika bekleyin.
10- Damıtılmış suyla yıkayın.
11- Kurumaya bırakılır ve örnek mikroskopta alınır..
Sporlar kırmızı ve mavi basilidir. Buharları solumamak önemlidir, çünkü zehirlidirler ve uzun vadede kanserojen olabilirler..
Isı olmadan modifiye Möeller tekniği
2007 yılında Hayama ve ortakları, Möeller tekniğinin bir modifikasyonunu yarattı. Boyanın ısıtma basamağını çıkardılar ve her 10 ml fuchsin-fenolik karbolik çözelti için 2 damla Tergitol 7 yüzey aktif cisminin ilavesiyle değiştirdiler. Aynı sonuçlar elde edildi.
uygulamaları
Sporların renklendirilmesi, patojenin tanımlanması için çok değerli ve yararlı bir bilgi sağlar, çünkü aynı şekilde olması, şekli, basil içindeki yeri ve vejetatif hücreyi deforme edebilmesi veya vermemesi, türleri yönlendirebilen verilerdir belirli bir cinsiyet dahilinde.
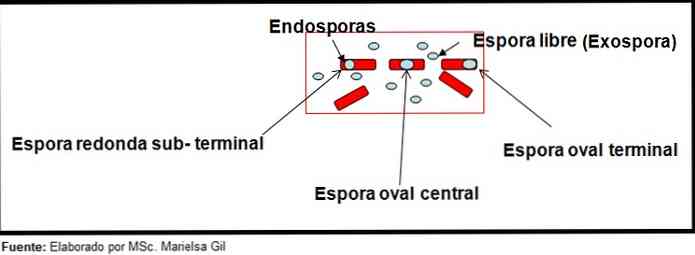
Bu bağlamda, sporların yuvarlak ya da oval olabileceğinden, merkeze ya da paracentral, subterminal ya da terminal pozisyonda olabileceğinden söz etmek gerekir..
Örnekler
- Clostridium difficile terminalde basiliği deforme eden oval bir spor oluşturur.
- Sporu Clostridium tertium Ovaldir, basilleri deforme etmez ve terminal seviyesinde bulunur.
- Endosporu Clostridium tetani terminaldir ve basilin deforme olmasını sağlar, bu da baget görünümünü verir.
- Sporları Clostridium botulinum, C. histolyticum'dan, C. Novy ve C. septicum yuvarlak veya alt ovaldirler ve basili deforme ederler.
- Endosporu Clostridium sordelli hafif bir deformasyon ile merkezi bir konumda bulunur.

referanslar
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Moeller'in yönteminde başarılı bir modifikasyon uygulanmadan bakteri sporlarının boyanması için basitleştirilmiş bir teknik önerisi. Eur J Med Res., 2007; 16 12 (8): 356-9.
- Wikipedia katılımcıları. Moeller lekesi. Vikipedi, Özgür Ansiklopedi. 3 Kasım 2018, 03:28 UTC. Erişim: en.wikipedia.org
- Pérez R, Jurez M, Rodríguez (2011). Mikrobiyolojik Teknikler Laboratuvarı El Kitabı. Mikrobiyoloji Akademisi Temel Bilimler Bölümü. Ulusal Politeknik Enstitüsü.
- "Endospor." Vikipedi, özgür ansiklopedi. 25 Şubat 2018, 10:20 UTC. 10 Ocak 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macias J ve ortak çalışanlar. (2006). Extremadura Özerk Topluluğu Çalışma Personeli. Özel gündem Cilt IV. Editörden MAD. Sevilla-İspanya, s. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006) Galiçya Sağlık Servisi (SERGAS) uzman laboratuar teknisyeni. Konuya özel cilt hacmi 2. Editörden MAD. Sevilla-İspanya, s. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiyolojik tanı (5. basım). Arjantin, Editör Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott'un Mikrobiyolojik Tanısı. 12 ed. Arjantin. Panamericana S.A Editörden


