Karbon tetraklorür (CCl4) yapısı, özellikleri, kullanım alanları, toksisite
karbon tetraklorür Renksiz bir sıvıdır, eter ve kloroform kokusuna benzer şekilde hafif tatlı bir koku alır. Kimyasal formülü CCl'dir.4, ve buharı havadan daha yoğun olan kovalent ve uçucu bir bileşik oluşturur; Elektriğe elverişli değildir, yanıcı değildir..
Atmosferde, nehirlerin suyunda, denizde ve deniz yüzeyinin sedimentlerinde bulunur. Kırmızı alglerde bulunan karbon tetraklorürün aynı organizma tarafından sentezlendiği düşünülmektedir..
Atmosferde, klor ve metan reaksiyonu ile üretilir. Endüstriyel olarak üretilen karbon tetraklorür, okyanusa, çoğunlukla deniz-hava arayüzü yoluyla girer. Atmosferik akışının>> okyanusu 1.4 x 10 olduğu tahmin edilmektedir.10 g / yıl, atmosferin toplam karbon tetraklorürünün% 30'una eşdeğer.
indeks
- 1 ana özellikleri
- 2 yapı
- 3 Fiziksel ve kimyasal özellikler
- 4 Kullanım
- 4.1 Kimyasal üretim
- 4.2 Soğutucu akışkan imalatı
- 4.3 Yangının bastırılması
- 4.4 Temizleme
- 4.5 Kimyasal analiz
- 4.6 Kızılötesi spektroskopisi ve nükleer manyetik rezonans
- 4.7 Çözücü
- 4.8 Diğer kullanımlar
- 5 Toksisite
- 5.1 Hepatotoksik mekanizmalar
- 5.2 Renal sistem ve merkezi sinir sistemi üzerindeki toksik etkiler
- 5.3 İnsan maruziyetinin etkileri
- 5.4 Zehirli etkileşimler
- 6 Moleküller arası etkileşimler
- 7 Kaynakça
Ana özellikleri
Karbon tetraklorür, endüstriyel olarak metanın termal klorlanması ile üretilir, metan, 400 ° C ila 430 ° C arasındaki bir sıcaklıkta klor gazı ile reaksiyona sokulur. Reaksiyon sırasında, ham ürün üretilir ve yan ürün hidroklorik asit kullanılır..
Aynı zamanda endüstriyel olarak karbon disülfid metodu ile üretilir. Klor ve karbon disülfid, katalizör olarak demir kullanılarak 90 ° C ila 100 ° C'lik bir sıcaklıkta reaksiyona sokulur. Ardından, ham ürün fraksiyonlama, nötralizasyon ve damıtma işlemine maruz kalır.
CCİ4 diğerleri arasında birçok kullanım alanı vardır: yağ, yağ, cila vb. çamaşırların kuru temizliği; pestisit, tarımsal ve fungisit fümigasyonlarında ve Naylon üretiminde. Bununla birlikte, büyük yararına rağmen, kullanımının yüksek toksisite nedeniyle kısmen ekarte edilmiştir..
İnsanlarda cilt, gözler ve solunum yolu üzerinde toksik etkiler oluşturur. Ancak en zararlı etkileri, merkezi sinir sisteminin, karaciğerin ve böbreklerin işleyişinde ortaya çıkar. Böbrek hasarı belki de karbon tetraklorürün toksik etkisine bağlı ölümlerin ana nedenidir..
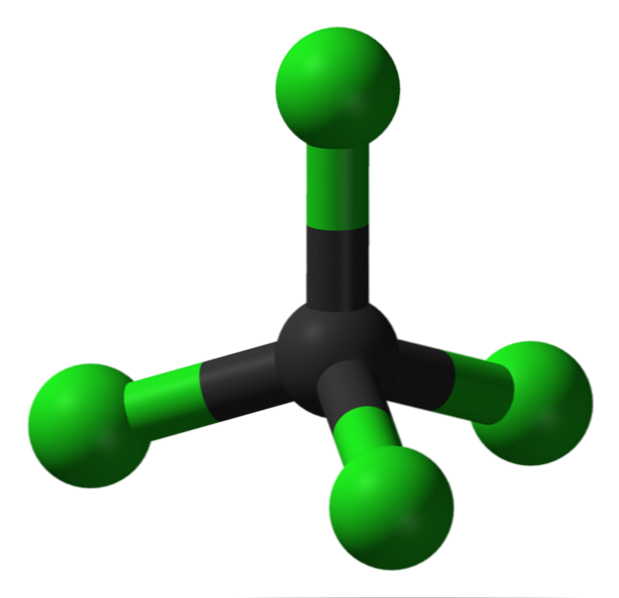
yapı
Resimde, tetrahedral geometri olan karbon tetraklorür yapısını görebilirsiniz. Cl atomlarının (yeşil küreler), bir tetrahedron çizerek karbon (siyah küre) etrafındaki alana yönlendirildiğine dikkat edin..
Ayrıca, tetrahedronun tüm köşeleri aynı olduğu için yapının simetrik olduğu; yani, CCl molekülünün nasıl döndürüldüğü önemli değildir4, Her zaman aynı olacak. Sonra, CCl’nin yeşil tetrahedronundan beri.4 simetrik olup, sonuç olarak kalıcı dipol momentinin olmaması.
Neden? C-Cl bağları, C'ye göre C'nin daha fazla elektronegatifliği nedeniyle kutupsal olmasına rağmen, bu anlar iptal edilir. vektörel. Bu nedenle apolar klorlu bir organik bileşiktir..
CCl'de karbon tamamen klorlanmış4, yüksek oksidasyona eşit olan (karbon klor ile maksimum dört bağ oluşturabilir). Bu çözücü elektronları kaybetme eğiliminde değildir, aprotiktir (hidrojenleri yoktur) ve bir taşıma aracı ve küçük klor depolanması anlamına gelir..
Fiziksel ve kimyasal özellikler
formül
CCI4
Moleküler ağırlık
153,81 g / mol.
Fiziksel görünüm
Renksiz bir sıvıdır. Monoklinik kristaller şeklinde kristalleşir.
koku
Diğer klorlu çözücülerde bulunan karakteristik kokuyu sunar. Koku aromatik ve biraz tatlıdır, tetrakloroetilen ve kloroform kokusuna benzer.
Kaynama noktası
170.1 ºF (76.8 ºC) ila 760 mmHg.
Erime noktası
-9ºF (-23ºC).
Suda çözünürlük
Suda çok az çözünür: 25ºC'de 1.16 mg / mL ve 20ºC'de 0.8 mg / mL. Neden? Çünkü yüksek polar bir molekül olan su, apolar olan karbon tetraklorür için bir afinite "hissetmez"..
Organik çözücülerde çözünürlük
Moleküler yapısının simetrisi nedeniyle, karbon tetraklorür polar olmayan bir bileşiktir. Bu nedenle, alkol, benzen, kloroform, eter, karbon disülfür, petrol eteri ve nafta ile karışabilir. Aynı şekilde, etanol ve asetonda çözünür.
yoğunluk
Sıvı halde: 68 ° F'da 1.59 g / ml ve 20 ° C'de 1.594 g / ml.
Katı halde: -186 ° C'de 1.831 g / ml ve -80 ° C'de 1.809 g / ml.
kararlılık
Genellikle inert.
Aşındırıcı eylem
Bazı plastiklere, lastiklere ve kaplamalara saldırır.
Ateşleme noktası
Tutuşma noktasını 982 ºC'den düşük gösteren çok yanıcı olarak kabul edilmez..
Otomatik ateşleme
982 ° C (1800 ° F; 1255 K).
Buhar yoğunluğu
Hava ile ilgili 5.32, 1'e eşit bir referans değer olarak alınmıştır..
Buhar basıncı
68 ° F'da 91 mmHg; 77 ºF'de 113 mmHg ve 25 atC'de 115 mmHg.
ayrışma
Ateşin varlığında klorür ve fosjen, kuvvetli toksik bileşik oluşturur. Aynı şekilde, aynı koşullar altında hidrojen klorür ve karbon monoksitte ayrışır. Yüksek sıcaklıklarda su varlığında, hidroklorik aside neden olabilir.
viskozite
2,03 x 10-3 Pa · s
Koku eşiği
21.4 ppm.
Kırılma indeksi (ηD)
1,4607.
uygulamaları
Kimyasal üretim
-Organik klor üretiminde klorlama maddesi ve / veya çözücü olarak işlev görür. Aynı şekilde, Naylon üretiminde monomer olarak müdahale eder.
-Kauçuk çimentosu, sabun ve böcek ilacı imalatında çözücü olarak görev yapar..
-Kloroflorokarbon itici gaz üretiminde kullanılır.
-C-H bağlarına sahip olmadığında, karbon tetraklorür serbest radikal reaksiyonlara girmez, bu nedenle halojenasyonlar için ya temel bir halojen ya da N-bromosüksinimit gibi bir halojenasyon reaktifi ile halojenasyon için faydalı bir çözücüdür..
Soğutucu akışkan imalatı
Kloroflorokarbon, soğutucu R-11 ve trikloroflorometan, soğutucu R-12 üretiminde kullanılmıştır. Bu soğutucular ozon tabakasını tahrip eder, bu yüzden Montreal Protokolünün tavsiyelerine göre kullanımlarının durdurulmasını tavsiye ettiler..
Ateşin bastırılması
20. yüzyılın başında, karbon tetraklorür, bileşiğin birtakım özelliklerine dayanarak bir yangın söndürücü olarak kullanılmaya başlandı: uçucu; buharı havadan ağırdır; Elektrik iletkeni değildir ve çok yanıcı değildir..
Isıtıldığında, karbon tetraklorür yanma ürünlerini kapsayan, bunları havada bulunan oksijenden izole eden ve yangının sönmesine neden olan ağır bir buhar haline gelir. Petrol yangınları ve cihazlarla mücadele için uygundur.
Bununla birlikte, 500 ° C'nin üzerindeki sıcaklıklarda, karbon tetraklorür su ile reaksiyona girerek toksik bir bileşik olan fosjene neden olabilir, bu nedenle kullanım sırasında havalandırmaya dikkat edilmelidir. Ek olarak, metalik sodyum ile patlayıcı reaksiyona girebilir, bu metal varlığında yangınlarda kullanılmasını önler.
temizlik
Evde kullanılan çamaşırların ve diğer malzemelerin kuru temizliğinde karbon tetraklorür kullanılmıştır. Ek olarak, endüstriyel metal yağ sökücü olarak kullanılır, yağ ve gresin çözülmesi için mükemmeldir..
Kimyasal analiz
Bor, bromür, klorür, molibden, tungsten, vanadyum, fosfor ve gümüş tespiti için kullanılır..
Kızılötesi spektroskopisi ve nükleer manyetik rezonans
-Karbon tetraklorür, 1600 cm'den büyük bantlarda önemli bir emilim göstermediğinden kızılötesi spektroskopide çözücü olarak kullanılır.-1.
-Tekniğe müdahale etmediğinden, hidrojene sahip olmadığı için aprotik olduğu için nükleer manyetik rezonansta bir çözücü olarak kullanılmıştır. Ancak toksisitesi nedeniyle ve solvent gücü düşük olduğu için karbon tetraklorür değiştirilmiş solventlerle değiştirildi..
tiner
Polar olmayan bir bileşik olma özelliği, yağların, yağların, verniklerin, verniklerin, lastik mumların ve reçinelerin çözücüsü olarak karbon tetraklorürün kullanılmasına izin verir. Ayrıca iyotu çözebilir.
Diğer kullanımlar
-Lav lambalarında önemli bir bileşendir, çünkü yoğunluğundan dolayı karbon tetraklorür balmumuna ağırlık ekler.
-Pul koleksiyoncuları tarafından kullanılır, pullarda filigranı hasar vermeden gösterir..
-Böcekleri yok etmek için böcek ilacı, mantar ilacı ve tahılların püskürtülmesinde kullanılmıştır..
-Metal kesme işleminde yağlayıcı olarak kullanılır..
-Veteriner hekimlikte koyunlarda Fasciola hepatica'nın neden olduğu fasciolasis'in tedavisinde anthermik olarak kullanılmaktadır..
toksisite
-Karbon tetraklorür solunum, sindirim, oküler ve cilt yollarından emilebilir. Yutulması ve solunması çok tehlikelidir çünkü beyin, karaciğer ve böbreklerde uzun süreli ciddi hasara neden olabilirler.
-Deri ile temas tahrişe neden olur ve uzun vadede dermatite neden olabilir. Gözle temas tahrişe neden olurken.
Hepatotoksik mekanizmalar
Karaciğer hasarına neden olan ana mekanizmalar oksidatif stres ve kalsiyum homeostazının değişmesidir..
Oksidatif stres, reaktif oksijen türlerinin üretimi ile vücudun, hücrelerinde oksidatif süreçleri kontrol eden indirgeyici bir ortam üretme kabiliyeti arasındaki bir dengesizliktir..
Normal redoks durumundaki dengesizlik, peroksitlerin ve hücrelerin tüm bileşenlerine zarar veren serbest radikallerin üretilmesinde toksik etkilere neden olabilir.
Karbon tetraklorür serbest radikal üreten metabolize edilir: Cl3C. (radikal triklorometil) ve Cl3COO. (radikal triklorometilperoksit). Bu serbest radikaller, karaciğer ve ayrıca akciğerde hasara neden olan lipoperoksidasyon üretir..
Serbest radikaller ayrıca karaciğer hücrelerinin plazma zarının yırtılmasına da neden olur. Bu, sitozolik kalsiyum konsantrasyonunda bir artışa ve hücre içi kalsiyum tutma mekanizmasında bir azalmaya neden olur..
Hücre içi kalsiyum artışı, fosfolipaz A enzimini aktive eder2 Membranın fosfolipitlerine etki eder, bu etkilenmesini arttırır. Ek olarak, nötrofillerin bir sızıntısı ve hepatosellüler hasar var. Enzimatik inaktivasyon ve hücre ölümüne neden olan hücresel ATP ve glutatyon konsantrasyonunda azalma var.
Böbrek sisteminde ve merkezi sinir sisteminde toksik etkiler
Karbon tetraklorürün toksik etkileri, böbrek sisteminde idrar ve vücut suyu birikimi üretiminde azalma ile kendini gösterir. Özellikle akciğerlerde ve kanda metabolik atık konsantrasyonunda bir artış. Bu ölüme neden olabilir.
Merkezi sinir sistemi düzeyinde, sinir uyarılarının aksonal iletimi söz konusudur..
İnsan maruziyetinin etkileri
Kısa süre
Gözlerin tahrişi; Karaciğer, böbrek ve merkezi sinir sistemi üzerindeki etkileri, bilinç kaybına neden olabilir.
Uzun süre
Dermatit ve olası kanserojen etki.
Zehirli etkileşimler
Karbon tetraklorür ile zehirlenme vakalarının çoğu ile alkol tüketimi arasında bir ilişki vardır. Aşırı alkol alımı, bazı durumlarda karaciğer sirozu yaratarak karaciğerde hasara neden olur.
Karbon tetraklorürün toksisitesinin, barbitüratlarla arttığı, çünkü bunların bazı benzer toksik etkilere sahip olduğu gözlenmiştir..
Örneğin, böbrek düzeyinde, barbitüratlar idrar atılımını azaltır, bu barbitüratlar karbon tetraklorürün böbrek fonksiyonu üzerindeki toksik etkisine benzerdir.
Moleküller arası etkileşimler
CCİ4 Yeşil bir tetrahedron olarak kabul edilebilir. Diğerleriyle nasıl etkileşime girer??
Bir kutupsal molekül olarak, kalıcı dipol momenti olmadan, dipol-dipol kuvvetleriyle etkileşime giremez. Moleküllerini sıvı içinde bir arada tutmak için, klor atomlarının (tetrahedranın köşeleri) birbirleriyle bir şekilde etkileşmesi gerekir; Londra'nın dağılma kuvvetleri sayesinde başarılı oldular.
Cl atomlarının elektronik bulutları hareket eder ve kısa anlar için zengin ve zayıf elektron alanları oluşturur; yani anında dipol üretirler.
Zengin elektron alanı δ- komşu bir molekülün Cl atomunun polarize olmasına neden olur: Clδ-δ+Cl Böylece, iki Cl atomu sınırlı bir süre bir arada tutulabilir.
Ancak, milyonlarca CCl molekülüne sahip olmak4, etkileşimler normal şartlar altında bir sıvı oluşturacak kadar etkili olur.
Ek olarak, her C'ye kovalent olarak bağlanan dört Cl, bu etkileşimlerin sayısını büyük ölçüde arttırır; o kadar yüksek bir kaynama noktası olan 76.8ºC'de kaynar ki.
CCİ'nin kaynama noktası4 tetrahedralar diğer apolar bileşiklerle karşılaştırıldığında (144ºC'de kaynayan ksilen gibi) nispeten daha küçük olduğu için daha yüksek olamaz..
referanslar
- Hardinger A. Steven. (2017). Resimli Organik Kimya Sözlüğü: Karbon tetraklorür. Aldığı kaynak: chem.ucla.edu
- Hepsi Siyavula. (N.D.). Moleküller Arası ve İnteratomik Kuvvetler. Siyavula.com'dan alındı
- Carey F. A. (2006). Organik Kimya (Altıncı baskı). Mc Graw Hill.
- Vikipedi. (2018). Karbon tetraklorür. Alınan: en.wikipedia.org
- Pubchem. (2018). Karbon Tetraklorür. Alınan: pubchem.ncbi.nlm.nih.gov
- Kimyasal Kitap (2017). Karbon tetraklorür. Kimden alındı: chemicalbook.com


