Sodyum Sülfat Formülü, Özellikleri, Yapısı, Uygulamaları
sodyum sülfat (sülfürik asidin disodyum tuzu, disodyum tetraoksidosülfat, soda sülfat, Glauber tuzu, thenardite, mirabilit) Na formülü ile inorganik bileşiktir.2GB4 ve bununla ilgili hidratlar. Tüm formlar suda oldukça çözünür olan beyaz katılardır.
Pazarlanan ana kimyasal ürünlerden biri olarak kabul edilir. Dünya çapındaki üretimi (neredeyse yalnızca dekahidrat şeklinde), yıllık yaklaşık 6 milyon tona ulaşıyor.

Ardından, kurak buharlaşan ortamlarda, kuru mağaralarda, eski madencilik işlemlerinde, çiçeklenme olarak ve fumaroles çevresinde bir birikme olarak üretilen susuz sodyum sülfat mineralidir..
İlk olarak 1825 yılında Salinas Espartinas'ta (Ciempozuelos, Madrid, İspanya) tanımlandı ve Fransız kimyager Louis Jacques Thénard (1777-1826) onuruna thenardita seçildi..

Avusturya yay su içinde, sodyum sülfat dekahidrat (daha sonra Glauber tuzu olarak bilinir) 1625 yılında keşfedilmiş Alman / Hollanda kimyager ve eczacı Rudolf Johann Glauber (1604-1670). O dolayı tıbbi özellikleri için, tuz mirabilis (mucizevi tuz) denir.
1650 ve 1660 arasında Glauber, yaygın tuzdan (NaCl) ve konsantre sülfürik asitten sodyum sülfat üretmeye başladı. Bu işlem kimya endüstrisinin başlangıcı olarak kabul edilir..
Kristalleri 20. yüzyıla kadar müshil olarak kullanılmıştır..
On sekizinci yüzyılda, Glauber tuzunun potasyum (potasyum karbonat) ile reaksiyonu endüstriyel soda külü (sodyum karbonat) üretiminde kullanılmaya başlandı..

Günümüzde esas olarak deterjan üretimi için ve Kraft kağıt hamuru üretimi için kullanılmaktadır (kağıt üretiminde baskın yöntem)..
Sodyum sülfat mineral yatakları Amerika Birleşik Devletleri, Kanada, İspanya, İtalya, Türkiye, Romanya, Meksika, Botsvana, Çin, Mısır, Moğolistan ve Güney Afrika'da bulunmaktadır..
Başlıca üreticiler Çin (Jiangsu ve Sichuan eyaletlerinde) ve ardından dünyanın en büyük glauberit yataklarının bulunduğu İspanya (Cerezo de Rio Tirón, Burgos).
Dünyadaki toplam doğal sodyum sülfat üretiminin 8 milyon ton civarında olduğu tahmin edilmektedir ve 2 ila 4 Mt arasında diğer endüstriyel işlemlerin bir yan ürünü olarak elde edilmektedir..
İspanya'da, Ulusal Kaynak Envanter Sülfat ve diğer güncel verilerle, "rezerv" olarak listelenen 730 Mt sırasına göre sodyum sülfat mineralleri stokları üzerindeki bilgilere göre tahmin edilir ve 300 Mt "diğer kaynakların" olarak sınıflandırılan.
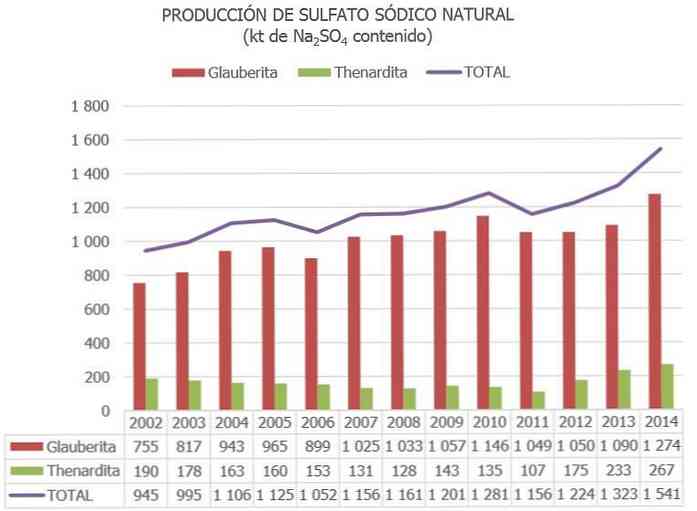
Avrupa Birliği'nde, İspanya şu anda sodyum sülfat cevherlerine sahip tek ülkedir (çoğunlukla Thenardite, Glauberite ve Mirabilite).
Şu anda tekstil sektöründe sodyum sülfat talebinde genel bir düşüş var.
Son yıllarda, deterjan gibi diğer sektörler, bazı bölgelerde, hammadde olarak düşük fiyatlarından dolayı bir miktar büyüme yaşamıştır..
Sodyum sülfat deterjanları için ana genişleyen pazarlar Asya, Orta Amerika ve Güney Amerika'da bulunur..
formüller

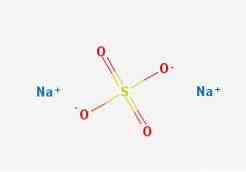
2D yapı
3B yapı
özellikleri
Fiziksel ve kimyasal özellikler
Sodyum sülfat, reaktif sodyum bileşikleri grubuna, ayrıca sülfat, hidrojensülfatlar ve disülfit grubuna aittir..
çabuk parlama
Yanıcı olmayan bir maddedir. Tozlarının patlama riski yoktur..
reaktivite
Sodyum sülfat suda çok çözünür ve higroskopiktir. Çok sabittir, normal sıcaklıklarda çoğu oksitleyici veya indirgeyici maddeye karşı reaktif değildir. Yüksek sıcaklıklarda karbotermal indirgeme ile sodyum sülfite dönüştürülebilir..
Kimyasal olarak reaktif olmayan maddeler, tipik çevresel koşullar altında reaktif olmayan olarak kabul edilir (nispeten uç şartlarda veya katalizde reaksiyona girebilmesine rağmen). Yükseltgenme ve indirgenmeye karşı dirençlidir (zorlu koşullar hariç).
Tehlikeli kimyasal reaksiyonlar
Alüminyum sodyum veya potasyum sülfat ile birlikte eritildiğinde şiddetli bir patlama meydana gelir.
toksisite
Kimyasal olarak reaktif olmayan maddeler toksik değildir (bu gruptaki gaz halindeki maddeler asfiksiler olarak işlev görse de).
Sodyum sülfat genel olarak toksik olmadığı kabul edilmekle birlikte, dikkatli kullanılmalıdır. Toz astım veya geçici göz tahrişine neden olabilir. Bu risk, göz koruması ve bir kağıt maske takarak önlenebilir..
uygulamaları
Başlıca uygulamaları:
- deterjan tozu.
- kağıt hamuru.
- tekstil.
- cam.
- enzimlerin sentezi (şarap yapımı).
- insan ve hayvan yemi.
- eczane ürünleri.
- genel olarak temel kimya.
- çelik süreçler.
- Deterjan tozu
Sodyum sülfat çok ucuz bir malzemedir. En büyük kullanımı, evdeki toz deterjanlarda bir dolgu maddesi olarak tüketmektir. Dünya üretiminin% 50'si. Yeni kompakt veya sıvı deterjanlar sodyum sülfat içermez, bu nedenle bu kullanım azalmaktadır.
Özellikle ABD'de önemini azaltan bir başka sodyum sülfat kullanımı. ve Kanada, odun hamuru üretimi için Kraft işleminde. İşlemin ısıl verimindeki ilerlemeler, sodyum sülfat ihtiyacını büyük ölçüde azalttı.
Cam endüstrisi, sodyum sülfat için başka bir önemli uygulama sağlar. Avrupa'nın en büyük ikinci uygulamasıdır. Sodyum sülfat, küçük hava kabarcıklarını erimiş camdan atmaya yardımcı olmak için kullanılır.
Japonya'da en büyük sodyum sülfat uygulaması tekstil üretimindedir. Sodyum sülfat, boyaların elyaflara eşit şekilde nüfuz etmesine yardımcı olur ve boyamada kullanılan paslanmaz çelik kapları aşındırmaz (alternatif yöntem olan sodyum klorürün aksine).
Sodyum sülfat, 32 ° C'de verilen katıdan sıvıya faz değişimi sırasında yüksek ısı depolama kapasitesinden dolayı düşük kaliteli güneş ısısını (ısıtma uygulamalarında daha sonra serbest bırakmak için) depolamak için özellikle uygundur.
Soğutma uygulamaları için, sodyum klorür (NaCl) ortak tuzlu bir karışım erime noktasını 18 ° C'ye düşürür..
Laboratuvarda, susuz sodyum sülfat, inert bir kurutma maddesi olarak, organik çözeltilerden su izlerini çıkarmak için yaygın olarak kullanılır. Etkisi, magnezyum sülfatın etkisinden daha yavaştır, ancak kimyasal olarak etkisiz olduğu için çeşitli malzemelerle kullanılabilir..
Sodyum sülfat dekahidrat (Glauber tuzu) tarihsel olarak müshil olarak kullanılmıştır. Asetaminofen (asetaminofen) gibi bazı ilaçların aşırı dozdan sonra vücuttan atılmasında etkilidir..
Sodyum sülfat için diğer uygulamalar arasında halı kokuları imalatında bir katkı maddesi olarak, hayvan yemlerinde bir katkı maddesi olarak ve nişasta üretiminde bir katkı maddesi olarak kullanımı bulunmaktadır..
Klinik etkileri
Terapötik uygulamaları için, sodyum sülfat kabızlık tedavisinde kullanılan salin ve katartik müshil kategorisine aittir.
Tuzlu kathartikler, emilmeyen tuzun ozmotik etkisiyle bağırsakta akışkanları tutan ve dolaylı olarak peristalsiste bir artış sağlayan tuzlardır..
Tuzlu cathartics, gastrointestinal sistem tarafından zayıf bir şekilde emilir, bu nedenle, büyük miktarlarda alınmadığı sürece sistemik toksisite olası değildir. Bununla birlikte, büyük riskler, bileşiğin ozmotik etkilerine bağlı olarak dehidrasyon ve elektrolit değişikliklerine neden olabilir.
Kronik müshil kullanımı, yeme bozukluğu olan, Munchausen sendromu veya basit bozukluğu olan hastalarda ortaya çıkabilir. Genel olarak, hastalar karın krampları ile ilişkili mide bulantısı, kusma ve ishal görülür. Şiddetli etkiler dehidrasyon, hipotansiyon, hipernatremi ve elektrolit anormalliklerini içerebilir..
Güvenlik ve riskler
Kimyasalların Sınıflandırılması ve Etiketlenmesi İçin Küresel Uyumlaştırılmış Sistemin Tehlike Beyanları (SGA).
Kimyasalların Sınıflandırılması ve (GHS) Etiketlenmesi konusunda Küresel Uyumluluk Sistemi dünya çapında (Milletler'i tutarlı kriterler kullanılarak farklı ülkelerde kullanılan çeşitli sınıflandırma standartları ve etiketleme değiştirmek için tasarlanmış Birleşmiş Milletler tarafından oluşturulan uluslar arası kabul sistemidir Birleşik, 2015).
(; Birleşmiş Milletler, 2015; Avrupa Kimyasal Ajansı, 2017 pubchem 2017), aşağıdaki gibi tehlike sınıfları (ve GHS karşılık gelen bölüm) sınıflandırma standartları ve markalama ve sodyum sülfat için öneriler şunlardır:
GHS'nin tehlike sınıfları
H315: Cilt tahrişine neden olur [Uyarı Cilt aşınması / tahrişi - Kategori 2].
H317: Alerjik cilt reaksiyonlarına yol açabilir [Uyarı Duyarlılık, Cilt - Kategori 1].
H319: Ciddi göz tahrişine neden olur [Uyarı Ciddi göz hasarı / tahrişi - Kategori 2A].
H412: Uzun süreli olumsuz etkileri olan sucul organizmalar için zararlıdır [Sucul çevre için tehlikeli, uzun süreli tehlike - Kategori 3].
(PubChem, 2017)
İhtiyati kurulların kodları
P261, P264, P272, P273, P280, P302 + P352, P351 + P338 + P305, P321, P332 + P313, P333 + P313, P337 + P313, P362, başvurunuz P363, P501 ve.
referanslar
- ChemIDplus (2017) 7757-82-6'nın 3 boyutlu yapısı - Sodyum sülfat susuz [image]. Şu kaynaktan alındı: chem.nlm.nih.gov.
- ChemIDplus (2017) 7727-73-3 3D yapısı - Sodyum sülfat [USP] [image]. Şu kaynaktan alındı: chem.nlm.nih.gov.
- Dyet, D. (2007) Sodaville Mineral County Nevada yakınındaki Thenardite Sodyum sülfat [image] Alındığı kaynak: en.wikipedia.org.
- Avrupa Kimyasallar Ajansı (ECHA), (2017). Sınıflandırma ve Etiketleme Özeti. Uyumlaştırılmış sınıflandırma - 1272/2008 (EC) sayılı Yönetmeliğin Ek VI'sı (CLP Yönetmeliği). Sodyum sülfat.
- Grumetisho (2012) Mirabilita [image] Alındığı kaynak: es.wikipedia.org.
- Tehlikeli Maddeler Veri Bankası (HSDB). TOXNET. (2017). Sodyum sülfat Bethesda, MD, AB: Ulusal Tıp Kütüphanesi. Alınan: toxnet.nlm.nih.gov.
- İspanya Jeoloji ve Madencilik Enstitüsü (IGME) (2016). GLAUBERITA-THENARDITA (DOĞAL SODYUM SÜLFAT) 2014. Madencilik panoraması. Alınan: igme.es.
- Ulusal İş Güvenliği Enstitüsü (INSHT). (2010). Uluslararası Güvenlik Kimyasal Kayıtları. Sodyum sülfat. İstihdam ve Güvenlik Bakanlığı. Madrid. Öyle. Alınan kaynak: insht.es.
- Langbein Rise (2008) Kesintisiz kraft kağıt hamuru mil [görüntü] Alınan kaynak: wikimedia.org.
- Birleşmiş Milletler (2015). Kimyasal Ürünlerin Sınıflandırılması ve Etiketlenmesi için Küresel Uyumlaştırılmış Sistem (SGA) Altıncı Gözden Geçirilmiş Baskı. New York, ABD: Birleşmiş Milletler yayını. Alınan: unece.org.
- Ulusal Biyoteknoloji Bilgi Merkezi. PubChem Bileşik Veritabanı (2016) sodyum sülfat - PubChem Yapısı [image] Bethesda, MD, EU: Ulusal Tıp Kütüphanesi. Alınan: pubchem.ncbi.nlm.nih.gov.
- Ulusal Biyoteknoloji Bilgi Merkezi. PubChem Bileşik Veri Tabanı (2016) sodyum sülfat - PubChem Yapısı [image] Bethesda, MD, EU: Ulusal Tıp Kütüphanesi.
- Ulusal Biyoteknoloji Bilgi Merkezi. PubChem Bileşik Veritabanı. (2017). Sodyum sülfat dekahidratlandı. Bethesda, MD, AB: Ulusal Tıp Kütüphanesi. Alınan: pubchem.ncbi.nlm.nih.gov.
- Ulusal Biyoteknoloji Bilgi Merkezi. PubChem Bileşik Veritabanı. (2017). Sodyum sülfat Bethesda, MD, AB: Ulusal Tıp Kütüphanesi. Alınan: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Sodyum sülfat [image] Alınan:.
- Wikipedia (2017) Kraft süreci. Alınan: wikipedia.org.
- Wikipedia (2017) Mirabilita. Alınan: wikipedia.org.
- Wikipedia (2017) Mirabilite. Alınan: wikipedia.org.
- Wikipedia (2017) Sodyum sülfat. Alınan: wikipedia.org.
- Wikipedia (2017) Solfato di sodium decaidrate. Alınan: https://it.wikipedia.org.
- Wikipedia (2017) Sodyum sülfat. Alınan: wikipedia.org.
- Wikipedia (2017) Thenardita. Alınan: wikipedia.org.
- Wikipedia (2017) Thenardite. Alınan: .wikipedia.org.


