Çözünme Özellikleri, Çözme ve Çözücü ile Farklılıklar, Örnekler
Çözünen, bir çözümde,solventte çözünen maddedir. Genel olarak, çözünen daha az oranda bulunur ve katı, sıvı veya gaz halinde olabilir. Aksine, çözücü, daha fazla miktarda bulunan çözeltinin bileşenidir..
Örneğin, tuzlu suda, tuz çözünen ve su çözücüdür. Bununla birlikte, tüm çözücüler katı değildir veya çözücüler sıvı değildir.

Bu anlamda, birkaç çözünen ve çözücünün kombinasyonu vardır: sıvı içinde gaz, katı içinde gaz, sıvı içinde sıvı, katı içinde sıvı, sıvı içinde katı veya katı içinde katı.
Bir çözümde çözünenin hangisi olduğunu tanımak için iki husus dikkate alınmalıdır. İlk olarak, çözünen daha küçük oranda olan maddedir. Ek olarak, çözeltiye entegre edildiğinde fiziksel halini (katı, sıvı veya gaz) değiştirendir..
indeks
- 1 Çözeltiler, çözücüler ve çözücüler
- 2 Çözeltinin tanımı
- 3 özellikleri
- 3.1 Çözünürlük
- 3.2 Sıcaklık
- 3.3 Çözeltinin Doygunluğu
- 3.4 Basınç
- 3.5 Kutupluluk
- 4 Çözücü ve çözücü arasındaki farklar
- 5 çözünen örnekleri
- 5.1 Gaz halindeki solventler
- 5.2 Katı halde çözücüler
- 5.3 Sıvı haldeki solventler
- 5.4 Evde kullanılabilecek solütolar
- 6 Kaynakça
Çözeltiler, çözücüler ve çözücüler
Kimyada, bileşenleri, içerikleri boyunca eşit oranlara bölünmüş homojen karışımlar vardır. En yaygın homojen karışım türlerinden biri, bir çözücünün bir çözücü içinde çözündüğü, iki veya daha fazla maddenin kararlı homojen karışımları olan çözeltilerdir..
Çözeltiler, çözücüler ve çözeltiler, günlük durumlarda ve endüstriyelden laboratuvara değişen bir aralıkta gözlenir. Karışımlardan oluşan bu maddeler sundukları özellikler ve bunlar arasında meydana gelen kuvvetler ve / veya çekicilikler nedeniyle çalışmanın amacıdır..
Solute'un tanımı
Yukarıda belirtildiği gibi, bir çözünen madde çözücü olarak adlandırılan bir başkasında çözünen maddedir..
Genellikle çözünen madde daha küçük bir orana sahiptir ve maddenin üç durumundan herhangi birinde oluşabilir. Aynı fazda olan iki madde arasında bir çözelti verildiğinde, hangisinin çözünen ve hangisinin çözücü olduğunu tanımlamak için daha küçük bir oranda seçilme yöntemi kullanılır..
Çözeltinin çözünme kapasitesi çözünürlük ile yönetilecektir. Çözücünün sıcaklığı, bir çözelti oluşup oluşmadığını bilmek söz konusu olduğunda belirleyici bir faktörü de temsil eder, çünkü çözücünün sıcaklığı ne kadar yüksek olursa, bu çözülebilen çözünen miktarı o kadar fazladır..
Sürfaktanlar adı verilen ve yüksek sıcaklıklarda daha az çözünür olan maddeler var, ancak istisnalar ve özel rolleri yerine getiriyorlar.
Bir çözücünün bir çözelti oluşturmak için bir çözücüyle etkileşime girdiği süreç çözülme olarak tanımlanır ve van der Waals kuvvetlerinin çekiciliğine ek olarak bağlar ve hidrojen köprülerinin oluşumunu içerir..
özellikleri
Solütler, farklı eyaletlerde çok çeşitli kimyasal maddeler içerir, farklı çözünme kapasitelerine sahiptir ve homojen karışımların oluşumunda önemli bir rol oynayan sayısız özelliklere sahiptir. Çözeltilerin temel özelliklerinden bazıları şunlardır:
çözünürlük
Çözünürlük, bir bileşiğin başka bir maddede çözünme yeteneğidir. Bu kabiliyetin, sıvının belirli bir kabartma ile karışabilme kabiliyeti olan, karışabilirlik ile yakın bir ilişkisi vardır; Katılmıyorsanız, bu bir karışıklıktır.
Karışabilirliğin belirli bir sayıdan daha fazla bir aralığı vardır, bu nedenle bir maddenin diğerinde tamamen, kısmen ya da karışamadığı söylenebilir..
Bir çözücünün çözünebilir özelliği, sırasıyla, çözünen ve çözücü arasında oluşturulan moleküller arası kuvvetler dengesi üzerindeki etkisinden dolayı bu kapasiteyi artırabilen veya azaltabilen diğer faktörlere bağlıdır..
Bir damla çözgünün boyutu veya bir kristal yapısındaki düzen gibi beklenmeyen özellikler bile, çözünme yeteneklerini etkileyebilir..
sıcaklık
Çözeltinin çözündüğü sistemin sıcaklığı çözünürlüğünü etkileyebilir: çoğu katı ve sıvı için bunlar sıcaklık artışlarına göre çözünme kapasitesini arttırır.
Buna karşılık, gazlarda, yüksek sıcaklıklarda suda daha düşük bir çözünürlük, ancak organik çözücülerde daha büyük bir çözünürlük olarak gösterilen karmaşık bir davranış gözlenir..
Çözeltinin Doygunluğu
Bir çözeltinin çözünmeyi çözme derecesine doygunluğu, mümkün olduğu kadar çözünen çözeltiye doymuş bir çözelti denir. Bu noktadan sonra, eklenen çözünen kullanılmış kabın dibinde bir fazlalık olarak çökelecektir; Bundan önce, çözüm doymamış denir.
Doyma noktasını geçmek ve çözünen çözünen çözeltiyi sürdürebilmek mümkündür, ancak bu sıcaklıkta bir artış gerektirir. Fazla miktarda çözünen içeren ve ısıtılan bir çözeltiye aşırı doygun bir çözelti adı verilir..
basınç
Basınç değişiklikleri, bazı istisnai durumlar dışında (petrol borularında kalsiyum sülfat birikimi) haricinde, katı ve sıvıların çözünürlüğünü genellikle etkilemez, fakat gazlarda çözünme yeteneklerinin belirleyici bir faktörüdür..
Aslında, bir gazın bir çözücü içindeki çözünürlüğü, söz konusu çözücü üzerindeki o gazın kısmi basıncına doğrudan orantılıdır..
polarite
Bir çözünenin polaritesi çözünme kapasitesini ölçerken çok önemlidir; bir çözünen, sahip olduğu kimyasal bileşene benzer bir çözücü içinde daha iyi çözülür..
Örneğin, yüksek polar veya hidrofilik maddeler, polar olmayan maddelerde pratik olarak çözünmezken, yüksek polar çözücülerde daha fazla çözünürlüğe sahip olacaktır..
Benzer şekilde, moleküller arası kuvvetler çözülme ve çözücünün çözücüyü çözme kolaylığı ile önemli bir rol oynamaktadır: dipol-dipol kuvvetleri, hidrojen bağları ve diğer bağlar arttıkça çözücünün çözülme kabiliyeti artar. çözün ve bir çözüm oluştur.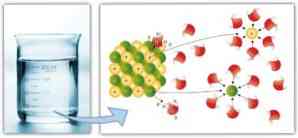
Çözücü ve çözücü arasındaki farklar
- Çözünen çözünmüş maddedir; çözücü, çözünenleri çözme aracıdır.
- Çözelti katı, sıvı veya gaz halinde olabilir; Çözücü genellikle sıvı fazdadır, fakat aynı zamanda katı ve gaz halinde bulunur..
- Çözeltinin çözünürlüğü daha çok yüzey gibi özelliklere bağlıdır; Solvat kapasitesi diğer faktörlerin yanı sıra polariteye, sıcaklığa ve basınca bağlıdır.
- Çözünürlük genellikle endüstriyel işlemlerde çıkarılması istenen bileşendir; Çözücü genellikle istenen bileşen değildir ve endüstriyel işlemlerde atılır.
Çözünen örnekleri
- Şeker, tipik olarak suyu tatlandırmak için kullanılan katı fazda bir çözelti örneğidir.
- Heksan, parafin mumunda bulunabilir ve bu katı daha dövülebilir hale getiren bir sıvı çözünen madde görevi görür..
- Karbondioksit, içlerine toz vermelerini sağlamak için içeceklere eklenen bir gazdır..
Gaz halindeki çözeltiler
Sudaki karbondioksit (alkolsüz içecekler)
Karbonik su, karbondioksit içeren sudur ve karbon dioksiti sudan basınç altında geçirerek üretilir..
Karbonatlı maden suları uzun süre doğal olarak oluşur. Bu efervesan sular, basınç altında çözünmüş bir akiferdeki aşırı karbondioksit nedeniyle oluşur..
En bilinen çözelti örneklerinden biri, bir şurupla birleştirilen, ticari meşrubatlardır..
Karbondioksitin varlığı bu suları ve alkolsüz içecekleri daha iştah açıcı ve görsel olarak çekici kılar..
Azottaki oksijen ve diğer gazlar (hava)
Atmosferdeki hava, farklı gaz moleküllerinden oluşur. Temel olarak% 78 azot ve yaklaşık% 21 oksijenden (çözünen) oluşur. Ek olarak, neredeyse% 1 argon ve diğer molekülleri içerir, fakat çok küçük miktarlarda.
Bütanda Propan (pişirme gazı)
Ayrıca sıvılaştırılmış petrol gazı (LPG) olarak da bilinen bu kombinasyon, 1860 yılından bu yana ev amaçlı bir yakıt kaynağı olarak kullanılmaya başlandı..
O zamandan beri hem yerli hem de endüstriyel kullanım için üretimini ve tüketimini genişletti. Her iki gaz da son derece kokusuz ve tehlikeli olduğundan, sızıntıyı algılayan kılan merkaptan adı verilen bir madde eklenir..
Katı halde solutolar
Bakır çinko (pirinç)
Pirinç olarak bilinen ticari alaşım, bakırda çözünmüş çinko (% 5 ila 40) ile oluşturulur. Çinko, çekme dayanımının arttırılmasına yardımcı olur. Kalay, demir, alüminyum, nikel ve silikon gibi diğer elementler bu alaşıma eklenebilir.
Alkolde iyot (iyot tentürü)
Halk arasında bilinen diğer bir çözünen örneği iyot tentürüdür. Bu çözelti etil alkolde iyot içerir (% 44 ila% 50). İyot tentür antiseptik olarak kullanılır.
Sudaki tuz (deniz suyu)
Deniz suyu, Dünya yüzeyinin% 70'inden fazlasını kapsar. Bu% 96.5 su,% 2.5 tuz ve daha az miktarda başka maddelerin karmaşık bir karışımıdır. Bu, inorganik ve çözünmüş organik materyalleri, partikülleri ve bazı atmosferik gazları içerir..
Sıvı halde çözücüler
Sudaki alkol (alkollü içecekler)
Şekerin fermantasyonundan gelen etanol veya etil alkol (çözünmüş), alkollü içecekler üretmek üzere sabit oranlarda suyla karıştırılır.
Bu bileşik vücut tarafından kolayca sindirilir, ancak aşırı tüketimi sağlıkta ciddi hasara neden olabilir.
Havadaki su (havadaki nem)
Havadaki su genellikle sis olarak bilinir. Bu, havada asılı küçük su damlalarından kaynaklanır ve temel olarak dünyanın gece boyunca soğumasından kaynaklanır..
Bu şekilde, bu soğutma çevre havasının sıcaklığını düşürmesine neden olur. Daha sonra, fenomen, içerisinde yoğuşan su tutulduğunda meydana gelir..
Sudaki asetik asit (sirke)
Sirke, lezzet katmak veya yiyecekleri korumak için kullanılan keskin bir tada sahip bir sıvıdır. Su ile karıştırılmış asetik asit çözeltisi ile hazırlanır..
Asetik asit konsantrasyonu değişkendir. Örneğin, damıtılmış sirke% 5 ila 8 arasında değişen bir orana sahiptir..
Gümüş Merkür (amalgam veya diş dolguları)
Dental dolgular için kullanılan amalgamlar, çözücü olarak işlev gören bir alaşım ile% 2 cıvadan oluşur. Bu alaşım% 70 gümüş içerir. Ayrıca kalay, bakır ve çinko ekleyebilirsiniz.
Evde kullanılabilecek solutoslar
Suda şeker
Şeker, moleküler ve polar bir bileşiktir ve bu nedenle, aynı zamanda bir polar element olan suda çözünme kabiliyetine sahiptir..
Şekeri yapılandırma şekli çözünme işleminin değişmesine neden olur. Örneğin, şeker topaklarda ise, çözünmesi tahılda olduğundan daha fazla zaman alır..
Bazı uzmanlar şekerli suyun vücut için çok önemli bir enerji kaynağı olduğuna inanır. Fiziksel aktivite yapan insanlarda bu çözümün etkinliğini ortaya çıkaran çalışmalar bile olmuştur..
Unda şeker
İlk önce katı terkip maddelerinin karıştırılması, ardından sıvıların eklenmesi bir kekin hazırlanması yaygındır..
Şeker, una bağlı olan ve kek için baz karışımına yol açan bir çözündür. Bu iki bileşene ek olarak, yumurta, tereyağı veya vanilya gibi diğerleri daha sonra eklenir.
Bu tür çözünen madde katıdır ve bu durumda katı olan bir çözücü ile karıştırılır. Elde edilen baz ayrıca tatlı ekmekler, kurabiyeler, kekler, pandispanyalar, küçük pudingler ve daha birçok tatlı yiyecek yapmak için de kullanılabilir..
Suda meyve suyu tozu
Bu elementi suda çözerek hazırlanan çok çeşitli toz meyve suları vardır. Bu durumda, çözünen meyve suyu tozu ve çözücü sudur.
Solventin miktarı çözünenden daha fazla olmalıdır, bu nedenle genellikle bir veya iki çorba kaşığı meyve suyu tozu bir bardak suda çözülür. Yine de, konsantrasyonu daha yüksek ve daha az miktarda kullanılması gereken bazı tozlar var..
İçerdikleri bileşenlerin (koruyucular, dengeleyiciler ve tatlandırıcılar olarak) diğerlerinin yanı sıra sağlığa zararlı olduğunu gösterdiğinden bu meyve sularının kırıcıları vardır..
Suda Klor
Suyu arıtmanın bir yolu, suda çözünmüş bir çözünen madde olarak klor kullanmaktır. Bu dezenfektan mikropları gidermek için en çok kullanılanlardan biri olması ile karakterize edilir ve içilemez suyu hızlı, ekonomik ve kolay bir şekilde içilebilir hale getirmek için idealdir..
Bu çözeltinin bir çözeltisi olarak klor, litrede 0.2 ve 0.5 miligramdan daha yüksek olmayan bir konsantrasyonda suya dahil edilmelidir..
Kullanılacak klor miktarı çok düşük olmalıdır, çünkü bu madde tüketildiğinde veya çok miktarda maruz kaldığında aşırı derecede toksik olabilir..
Suyun bu saflaştırma yöntemi klorlama olarak bilinir ve dağa yapılan bir gezinin ortasında veya suyun içinden geçtiği borularda bulunabilecek bakteri ve mikropları elimine etmek için evdeki suyu arıtmak için uygulanabilir..
Suda boyama
Su var olan en evrensel çözücüdür ve ayrıca boya gibi bir çözünen maddenin çözünebileceği temeldir..
Boya genellikle farklı nedenlerden dolayı çözünür. En yaygın olanı fırçaları ve boyamak için kullanılan diğer araçların temizlenmesini kolaylaştırmaktır..
Pek çok resim türü var; Suda en iyi çözülenler lateks olanlardır. Aletlerin daha iyi temizlenmesini sağlamanın yanı sıra, boyamaya başlamadan önce boyanın su ile seyreltilmesinin avantajı, boyanmış yüzeyde daha iyi bir sonuç elde edilmesini garanti etmesidir..
Suda süt tozu
Süt tozu, önceden pastörize edilmiş sütün dehidrasyonu yoluyla oluşan bir çözeltidir. Bu işlemin amacı sütün daha uzun süre daha iyi saklanabilmesini sağlamaktır..
Bu çözelti suda çözülür ve kahvaltıda, kahve ile birlikte veya çeşitli preparatlarda yaygın olarak alınan sıvı sütü oluşturur..
Meyve suyu tozu durumunda olduğu gibi, seyreltilecek süt miktarı, çözeltiyi hazırlamak istediğiniz su miktarından az olmalıdır.
Su içinde deterjan
Çamaşır yıkarken sıvı veya toz deterjanlar kullanılır. Bunlar, dezenfektan ve tekstil kumaş temizleyici olarak işlev gören bir çözelti oluşturmak üzere suda çözülür..
Bu çözeltide kullanılması gereken çözünen madde miktarı, deterjanın türüne, aynı malzemenin sunumuna ve sahip olduğu bileşenlere bağlı olarak değişkendir..
Deterjan ve sudan oluşan çözelti, su döküntüleriyle temas ettiğinde çok kirletici olabilir, bu nedenle çok kısa sürede bozulabilir ve çevreyi çok daha az bozabilecek biyolojik olarak çözünebilir deterjanların kullanılması önerilir..
jelatin
Jelatin, tendonlardan, bağlardan ve hayvan kemiklerinden oluşan bir elementtir. Bu bileşik toz halinde veya tabaka halinde olabilir..
Her iki durumda da, bu sonucun elde edilmesi için bu çözünenin sıcak suda eritilmesi gerekir: bir tatlı için ve birçok sağlık yararına sahip tatlı bir yemek.
Bu bileşiğin yararları arasında, hızlı doku tamirini desteklemesi ve antienflamatuar bir besin olmasıdır. Ek olarak, büyük miktarda protein içerir ve bağışıklık sisteminin güçlendirilmesinde önemli bir rol oynar.
Günlük az miktarda jelatin yemek, eklemlerin yenilenmesine yardımcı olur ve böylece osteoporozun görünümünü tahmin eder.
Sütlü Çikolata
Çikolata, kakao ve kakao yağı karışımı sayesinde oluşan bir elementtir. Bu yiyecek, sıcak çikolata olarak bilinen şeyleri hazırlamak için sütle karıştırıldığında çözünen bir madde olarak kullanılır..
Bu preparasyon için arzu edilen miktarda süt ısıtılır ve çikolata, sürekli olarak karıştırılarak, parçalar halinde, toz veya sıvı halde eklenir..
Böylece, bu çözünen maddenin en iyi şekilde çözünmesi ve topaklardan kaçınması için karışımı duraksamadan geçirmek gerekir..
Suda kakao tozu
Ayrıca kakao tozu kullanarak sıcak çikolata da hazırlayabilirsiniz. Bu çözünen sadece toz haline getirilmiş kakao kütlesi ile oluşturulur. Çikolatadan farklı olarak, kakao bu meyvenin yağını içermez.
Kakao, çikolata aromalı bir içecek oluşturmak için suda mükemmel şekilde çözülebilir. Bu durumlarda, karışımın şeker, bal veya bazı tatlandırıcı ile tatlandırılması esastır; aksi takdirde sonuç çok acı olacak.
referanslar
- Lambert, N. ve Mohammed, M. (1993). CXC için Kimya. Oxford: Heinemann.
- Steen, D.P. (2008). Karbondioksit, karbonatlaşma ve doldurma teknolojisinin ilkeleri. D.Pee Steen, Philip ve P.R. Ashurst (editörler), Gazlı Alkolsüz İçecekler: Formülasyon ve İmalat, s. 112-143. Oxford: Blackwell Yayıncılık.
- Havada ne var? (s / f). UÇAR Fen Eğitim Merkezi. 17 Ekim 2017'de eo.ucar.edu'dan alındı
- Sıvılaştırılmış petrol gazı. (2013, 12 Temmuz). Ansiklopedi Britannica.
16 Ekim 2017'de britannica.com'dan alındı - Lytle, D.A. ve Schock, M.R. (1996). Durgunluk Süresi, Kompozisyon, PH ve Ortofosfatın Pirinçten Metal Liçeğine Etkileri. Ohio: ABD Çevre Koruma Ajansı.
- Crabwee, T.D.; Pelletier, S.J. ve Pruett, T.L. (2001). Cerrahi Antisepsi S. S. Block (editör), Dezenfeksiyon, Sterilizasyon ve Muhafaza, s. 919-934. Philadelphia: Lippincott Williams & Wilkins.
- Byrne, R. H. ve arkadaşları (2017, 07 Haziran). Deniz suyu. Ansiklopedi Britannica. Britannica.com adresinden 17 Ekim 2017 tarihinde alındı
- Plutowska B. ve Wardencki, W. (2012). Alkollü içeceklerin gaz kromatografisi-olfaktometrisi. J. Piggott'ta (editör), Alkollü İçecekler: Duyusal Değerlendirme ve Tüketici Araştırmaları, s.101-122. Philadelphia: Woodhead Yayıncılık.
- Sis nedir (2017, 12 Temmuz). Met Office (İngiltere). metoffice.gov.uk
- Helmenstine, A. M ... (2016, 16 Şubat). Sirkenin Kimyasal Bileşimi Nedir? 17 Ekim 2017'de alınan düşünceco.com'dan alındı
- Phinney, D. J. ve Halstead, J. H. (2017). Diş Yardımı: Kapsamlı Bir Yaklaşım. Massachusetts: Cengage Öğrenme.
- Britannica, E. (s.f.). Çözüm-Kimya. Britannica.com sitesinden alındı
- Vikipedi. (N.D.). Çözünürlük. En.wikipedia.org sitesinden alındı
- Classzone. (N.D.). Çözünen. Frsd.k12.nj.us adresinden alındı
- ChemGuide. (N.D.). Doymuş Çözeltiler ve Çözünürlük. Chem.libretexts.org sitesinden alındı.
- Madhusha. (N.D.). Solvent ve Solute Arasındaki Fark. Pediaa.com adresinden alındı.


