Organik tuzların fiziksel ve kimyasal özellikleri, kullanımları ve örnekleri
organik tuzlar sayısız özelliği olan yoğun sayıda iyonik bileşiklerdir. Daha önce bir yük taşıyıcısı olmasına izin veren bir dönüşüm geçirmiş olan organik bir bileşikten türetilirler ve ayrıca kimyasal kimliği ilişkili iyona bağlıdır..
Aşağıdaki resimde organik tuzlar için iki çok genel kimyasal formül gösterilmiştir. Birincisi, R-AX, karbon atomu veya A grubu karbon yapısında pozitif yük + veya negatif (-) taşıyan bir bileşik olarak yorumlanır..
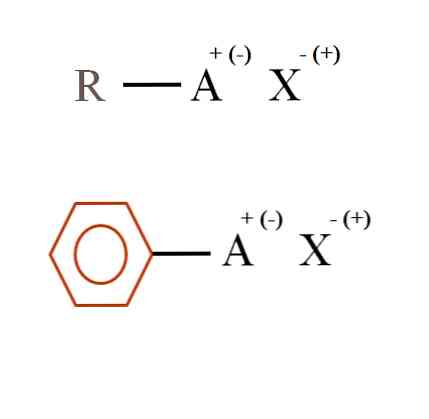
Görülebileceği gibi, R ve A, R-A arasında kovalent bir bağ vardır, ancak sırayla A, X iyonunu çeken (veya iten) resmi bir yüke sahiptir Yükün işareti A'nın doğasına ve kimyasal ortama bağlı olacaktır..
A pozitif olsaydı, kaç X ile etkileşime girebilirdi? Sadece biriyle, elektronotivite prensibi verilir (+ 1-1 = 0). Bununla birlikte, X'in kimliği nedir? Anyon X, CO olabilir32-, iki katyon RA gerektiren+; bir halojenür: F-, Cı-, br-, vb; hatta bir başka RA bileşiği-. Seçenekler hesaplanamaz.
Ayrıca, bir organik tuz, kahverengi benzen halkasında gösterilen aromatik bir karaktere sahip olabilir. Bakır benzoat tuzu (II), (C6'H5COO)2Örneğin Cu, Cu katyonuyla etkileşime giren negatif yüklü karboksil gruplarına sahip iki aromatik halkadan oluşur.2+.
indeks
- 1 Fiziksel ve kimyasal özellikler
- 1.1 Yüksek moleküler kütleler
- 1.2 Amfipiler ve yüzey aktif cisimleri
- 1.3 Yüksek kaynama veya erime noktaları
- 1.4 Asitlik ve bazlık
- 2 kullanır
- 3 Organik tuz örnekleri
- 3.1 Karboksilatlar
- 3.2 Lityum diakrilupratlar
- 3.3 Sülfonyum tuzları
- 3.4 Oxonyum tuzları
- 3.5 Amin tuzları
- 3.6 Diazonyum tuzları
- 4 Kaynakça
Fiziksel ve kimyasal özellikler
Görüntüden, organik tuzların üç bileşenden oluştuğu söylenebilir: organik, R veya Ar (aromatik halka), iyonik yükü A taşıyan bir atom veya grup ve bir karşı X.
Tıpkı kimyasal kimlik ve yapı bu bileşenler tarafından tanımlandığı için özellikleri bunlara bağlı.
Bu durumdan, bu tuzların büyük çoğunluğunu karşılayan bazı genel özellikler özetlenebilir..
Yüksek moleküler kütleler
Mono veya çok değerli inorganik X anyonları varsayıldığında, organik tuzlar genellikle inorganik tuzlardan çok daha büyük moleküler kütlelere sahiptir. Bunun nedeni basit C-C bağları ve hidrojen atomları olan karbon iskeletinin bileşik için çok fazla kütle katkısı olmasıdır..
Bu nedenle, yüksek moleküler ağırlıklarından R veya Ar sorumludurlar..
Amfipiler ve yüzey aktif maddeler
Organik tuzlar amfifilik bileşiklerdir, yani yapıları hem hidrofilik hem de hidrofobik uçlara sahiptir..
Bu uç noktalar nelerdir? R veya Ar, hidrofobik ucu temsil eder, çünkü C ve H atomları, su molekülleri için büyük bir afiniteye sahip değildir..
bir+(-), yükü taşıyan atom veya grup, hidrofilik uçtur, çünkü dipolar momentine katkıda bulunur ve su oluşturucu dipollerle (RA) etkileşime girer.+ OH2).
Hidrofilik ve hidrofobik bölgeler polarize olduğunda, amfifilik tuz bir deterjan üretimi için yaygın olarak kullanılan bir madde olan bir yüzey aktif madde haline gelir ve demulsifiyanlar.
Yüksek kaynama veya erime noktaları
İnorganik tuzlar gibi, organik tuzlar da sıvı veya katı fazda uygulanan elektrostatik kuvvetler nedeniyle yüksek erime ve kaynama noktalarına sahiptir..
Bununla birlikte, R veya Ar organik bileşenine sahip olan, elektrostatik ile belirli bir şekilde rekabet eden diğer Van der Waals kuvvetleri (Londra kuvvetleri, dipol dipol, hidrojen köprüleri)..
Bu nedenle, organik tuzların katı veya sıvı yapıları, ilk etapta daha karmaşık ve çeşitlidir. Bazıları gibi davranabilir bile sıvı kristaller.
Asitlik ve bazlık
Organik tuzlar genellikle inorganik tuzlardan daha güçlü asitler veya bazlardır. Bunun nedeni, örneğin amin tuzlarında A'nın, ilave bir hidrojen ile bağlanmasından dolayı pozitif bir yüke sahip olmasıdır:+-H. Daha sonra, bir baz ile temas halinde, nötr bir bileşik haline gelmek için protonu bağışlayın:
RA+H + B => RA + HB
H, A'ya aittir, ancak nötralizasyon reaksiyonuna müdahale ettiği için yazılmıştır..
Öte yandan, RA+ hidroksil anyon veya hidroksil OH ile yeterince kararlı bir kristalli ağa sahip katı maddeler oluşturamayan büyük bir molekül olabilir-.
Bu durumda, tuz RA+OH- güçlü bir üs gibi davranır; NaOH veya KOH kadar basit olsa bile:
RA+OH- + HCI => RACI + H2Ey
Kimyasal denklemde Cl anyonuna dikkat edin- OH yerini alır-, tuz RA'nın oluşturulması+Cı-.
uygulamaları
Organik tuzların kullanımı, R, Ar, A ve X'in kimliğine göre değişecektir. Ayrıca, hedeflendikleri uygulama, oluşturdukları katı veya sıvı türüne de bağlıdır. Bu konuda bazı genellemeler şunlardır:
-Diğer organik bileşiklerin sentezi için reaktif olarak görev yaparlar. RAX, iyi giden bir grubun yerine başka bir bileşiğe eklenecek R zincirinin bir "donörü" olarak işlev görebilir..
-Bunlar yüzey aktif cisimleridir, bu yüzden yağlayıcı olarak da kullanılabilirler. Bu amaçla karboksilat metal tuzları kullanılır.
-Çok çeşitli boyaların sentezlenmesine izin verirler..
Organik tuzlara örnekler
karboksilatlar
Karboksilik asitler nötrleştirme reaksiyonunda bir hidroksit ile reaksiyona girerek karboksilatların tuzlarına yol açar: RCOO- M+; M+ Herhangi bir metal katyon olabilir (Na+, Pb2+, K+, vb.) veya NH amonyum katyon4+.
Yağ asitleri uzun zincirli alifatik karboksilik asitlerdir, doymuş ve doymamış olabilirler. Palmitik asit (CH) doymuş arasında3(CH2)14COOH). Bu stearik asit (CH) iken palmitat tuzunu oluşturur3(CH2)16COOH stearat tuzunu oluşturur. Sabunlar bu tuzlardan oluşur.
Benzoik asit durumunda, C6'H5COOH (nerede C6'H5- bu bir benzen halkasıdır), bir bazla reaksiyona girdiğinde benzoat tuzlarını oluşturur. Tüm karboksilatlarda -COO grubu- A'yı (RAX) temsil eder.
Lityum diacupuprates
Lityum diakuprat organik sentezde faydalıdır. Formülü [R-Cu-R]-Li+, bakır atomunun negatif bir yük taşıdığı. Burada bakır, görüntünün A atomunu temsil eder..
Sülfonyum tuzları
Bir organik sülfitin bir alkil halojenürle reaksiyonundan oluşur:
R,2S + R'X => R2R'S+X
Bu tuzlar için, kükürt atomu pozitif bir formal yük taşır (S+) üç kovalent bağa sahip.
Oxonyium tuzları
Ayrıca eterler (sülfürlerin oksijenli analogları), oksonyum tuzlarını oluşturmak için hidroksitlerle reaksiyona girer:
ROR '+ HBr <=> RO+İK '+ Br-
HBr'nin asit protonu eter (R'nin oksijen atomuna kovalent olarak bağlanır)2Ey+-H), pozitif olarak yükleniyor.
Amin tuzları
Aminler, birincil, ikincil, üçüncül veya dördüncül ve ayrıca bunların tuzları olabilir. Hepsi azot atomuna bağlı bir H atomu ile karakterize edilir.
Yani, RNH3+X- bu bir birincil amin tuzudur; R,2NH2+X-, sekonder aminin; R,3NH+X-, üçüncül aminin; ve R4N-+X-, kuaterner aminin (kuaterner amonyum tuzu).
Diazonyum tuzları
Son olarak, diazonyum tuzları (RN2+X-) veya arildiazonyum (ArN)2+X-), birçok organik bileşik, özellikle de azo boyası için başlangıç noktasını temsil eder..
referanslar
- Francis A. Carey. Organik Kimya (Altıncı baskı, s. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organik Kimya Aminler. (10. baskı.). Wiley Plus.
- Vikipedi. (2018). Tuz (Kimya). Alındığı kaynak: en.wikipedia.org
- Steven A. Hardinger. (2017). Resimli Organik Kimya Sözlüğü: tuzlar. Aldığı kaynak: chem.ucla.edu
- Chevron Oronit. (2011). Karboksilatları. [PDF]. Alınan: oronite.com


