Nötr atom nedir? (Örneklerle)
bir nötr atom Protonlarının sayısı ile elektronlar arasındaki bir telafi nedeniyle elektrik yükü bulunmadığı. Her ikisi de elektriksel olarak yüklü atom altı parçacıklardır.
Protonlar, nötronların yanında toplanır ve çekirdeği oluşturur; Elektronlar bir elektronik bulut tanımlanarak yayılırlar. Bir atomdaki proton sayısı, atom numarasına (Z) eşit, elektron sayısına eşit olduğunda, atom içindeki elektrik yükleri arasında bir telafi olduğu söylenir..
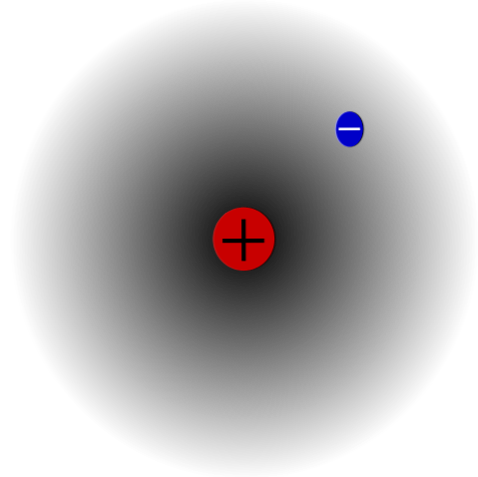
Örneğin, bir proton ve bir elektrona sahip olan bir hidrojen atomu (üst görüntü) vardır. Proton atomun merkezinde, çekirdeği olarak konumlandırılırken, elektron çevre boşluğa yuvarlanır ve çekirdekten uzaklaştıkça elektron yoğunluğunun düşük olduğu bölgeler bırakır..
Bu nötr bir atom çünkü Z'nin elektron sayısına eşit olduğu doğru (1p = 1e). H atomu bu tek protonu kaybederse, atom yarıçapı büzülür ve proton yükü hakim olur ve H katyonu olur.+ (Hydron). Öte yandan, bir elektron kazanırsa, iki elektron olacak ve H anyonu olacaktı.-- (Hidrit).
indeks
- 1 Nötr atom vs iyon
- 1.1 Na ile Na+
- 2 nötr molekül
- 3 Örnekler
- 3.1 Oksijen
- 3.2 Bakır
- 3.3 Soy gazlar
- 3.4 Metal alaşımları
- 4 Kaynakça
Nötr atom vs iyon
H'nin nötr atomunun örneği için proton sayısının elektron sayısına eşittir (1 p = 1e); tarafından türetilen iyonlarla oluşmayan durum elektron kaybı veya kazancı.
İyonlar, elektron sayısındaki bir değişiklik ile oluşur, çünkü atom onları kazanır (-) veya kaybeder (+).
Katyonun atomunda H+ Soliter protonun değer yükü, bir elektronun toplam yokluğunun önünde baskındır (1p> 0e). Bu periyodik tablonun diğer tüm ağır atomları (np> ne) için geçerlidir..
Olumlu bir ücretin varlığı önemsiz görünse de, söz konusu elementin özelliklerini çapraz olarak değiştirir..
Öte yandan, anyon atomunda H- İki elektronun negatif yükü, tek çekirdekli protonun (1p) önünde baskındır.<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Daha iyi bilinen bir örnek metalik sodyumdur. Z = 11 olan nötr atomu Na, 11 protona sahiptir; bu nedenle, pozitif yükleri telafi etmek için 11 elektron olması gerekir (11 p = 11e).
Yüksek elektropozitif metalik bir element olan Sodyum elektronlarını çok kolay bir şekilde kaybeder; Bu durumda, değer kabuğunun yalnızca bir tanesini kaybeder (11p> 10e). Böylece, Na katyonu oluşur+, elektrostatik olarak bir anyonla etkileşime giren; klorür gibi, Cl-, tuz sodyum klorür içinde NaCl.
Metalik sodyum zehirli ve tahriş edicidir, katyonu hücrelerde bile bulunur. Bu, bir elementin özelliklerinin elektronları kazandığında veya kaybettiğinde büyük ölçüde değişebileceğini gösterir.
Öte yandan, Na anyon- (soduro, varsayımsal olarak) yoktur; ve oluşturabilmek için, son derece reaktif olacaktır, çünkü elektron elde etmek için sodyumun kimyasal yapısına karşıdır. Na- çekirdeğinin pozitif yükünü aşan 12 elektronu olurdu (11p<12e).
Nötr moleküller
Atomlar, aynı zamanda bileşikler olarak da adlandırılabilen moleküllere yol açmak için kovalent olarak bağlanır. Bir molekül içinde izole edilmiş iyon olamaz; bunun yerine, pozitif veya negatif formal yüklere sahip atomlar vardır. Bu yüklü atomlar molekülün net yükünü etkiler ve bunu bir polyatomik iyon haline dönüştürür.
Bir molekülün nötr olması için, atomlarının formal yüklerinin toplamı sıfıra eşit olmalıdır; veya, daha basit olarak, bütün atomları nötrdür. Bir molekülü oluşturan atomlar nötr ise, bu da olacaktır..
Örneğin, su molekülüne sahipsin, H2O. İki H atomu, tıpkı oksijen atomu gibi nötrdür. Hidrojen atomunun görüntüsünde gösterildiği gibi temsil edilemezler; çünkü çekirdek değişmese de, elektronik bulut değişiyor.
Hidronyum iyonu, H3Ey+, Öte yandan, kısmi pozitif yük ile bir oksijen atomuna sahiptir. Bu, poliyatomik iyonda bir elektronu kaybettiği ve bu nedenle proton sayısının elektronlarından daha fazla olduğu anlamına gelir.
Örnekler
oksijen
Nötr oksijen atomu 8 proton ve 8 elektrona sahiptir. İki elektron kazandığında, anyon oksit, OR olarak bilinen şeyi oluşturur.2-. İçinde iki elektronun fazla olması nedeniyle negatif yükler baskındır.<10e).
Nötr oksijen atomları, O oluşturmak üzere kendileriyle reaksiyona girme ve kendilerine bağlanma eğilimindedir2. Bu nedenle kaderi için atom veya “gevşek” olması ve hiçbir şeyle tepki vermemesidir. Bu gaz için bilinen tüm reaksiyonlar, moleküler oksijene, OR'a bağlanır2.
bakır
Bakır 29 proton ve 29 elektrona sahiptir (nötronlara ek olarak). Oksijenin aksine, nötr atomları metal bağları ve bağıl kararlılıkları nedeniyle doğada bulunabilir..
Sodyum gibi, onları kazanmak yerine elektronları kaybetme eğilimindedir. Elektronik konfigürasyonu ve diğer yönleri göz önüne alındığında, bir veya iki elektronu kaybederek bakır katyonlar oluşturur, Cu+, veya kuprik, Cu2+, sırasıyla.
Cu katyonu+ bir tane daha az elektrona sahiptir (29p<28e), y el Cu2+ iki elektron kaybetti (29p<27e).
Soy gazlar
Asil gazlar (He, Ne, Ar, Kr, Xe, Rn), nötr atomları şeklinde var olan az sayıdaki elementlerden biridir. Atom numaraları: sırasıyla 2, 10, 18, 36, 54 ve 86. Elektron kazanmazlar veya kaybetmezler; Bununla birlikte, Xenon, Xe, florin ile bileşikler oluşturabilir ve elektronları kaybedebilir..
Metal alaşımları
Metaller korozyona karşı korunursa, metal bağlarıyla metal nötr atomlarını koruyabilir. Alaşımlarda, metallerin katı çözeltileri, atomlar (çoğunlukla) nötr kalır. Örneğin pirinçte, nötr Cu ve Zn atomları vardır..
referanslar
- Jetser Carasco. (2016). Nötr atom nedir? Alınan: giriş- to-physics.com
- İşaretler, Samuel. (25 Nisan 2017). Nötr Olmayan Atom Örnekleri. Sciencing. Şu kaynaktan alındı: sciencing.com
- Chem4Kids. (2018) İyonlara bakmak. Şu kaynaktan alındı: chem4kids.com
- Whitten, Davis, Peck ve Stanley. (2008). Kimya. (8. basım). CENGAGE Öğrenme.
- Shiver ve Atkins. (2008). İnorganik kimya (Dördüncü baskı). Mc Graw Hill.


