Moleküler geometri türleri ve örnekler
moleküler geometri veya moleküler yapı atomların merkezi bir atom etrafındaki uzamsal dağılımıdır. Atomlar, yüksek bir elektronik yoğunluğun olduğu bölgeleri temsil eder ve bu nedenle, oluşturan bağlantılardan bağımsız olarak (tek, çift veya üçlü) elektronik gruplar olarak kabul edilir..
Bu kavram iki teorinin kombinasyonundan ve deneysel verilerinden doğar: değerlik bağının (TEV) ve değerlik kabuğunun elektronik çiftlerinin itilmesi (VSPR). Birincisi bağlantıları ve açılarını tanımlarken, ikincisi geometriyi ve dolayısıyla moleküler yapıyı kurar..

Moleküller hangi geometrik şekilleri benimseyebilir? Önceki iki teori cevapları veriyor. VSEPR'ye göre, serbest elektron atomları ve çiftleri, aralarındaki elektrostatik itmeyi en aza indirecek şekilde uzayda düzenlenmiş olmalıdır..
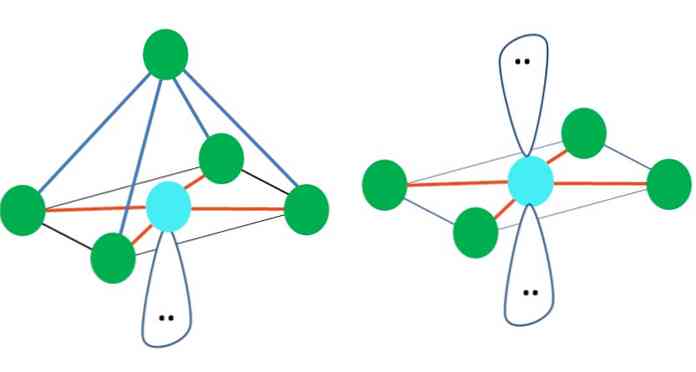
Bu nedenle, geometrik şekiller keyfi değildir, ancak en sağlam tasarıma bakın. Örneğin, üst resimde solda bir üçgen ve sağda bir oktahedron görülebilir. Yeşil noktalar atomları ve turuncu çizgiler bağlantıları temsil eder..
Üçgenin içindeki üç yeşil nokta, 120 ° 'lik bir ayrılıkla yönlendirilir. Bağınkine eşit olan bu açı, atomların birbirlerini mümkün olduğunca az püskürtmelerini sağlar. Bu nedenle, diğer üçüne bağlı merkezi bir atomu olan bir molekül, trigonal düzlem geometrisini benimseyecektir..
Bununla birlikte, VSCR, merkezi atomdaki serbest bir çift elektronun geometriyi bozacağını tahmin eder. Trigonal düzlem için, bu çift üç yeşil noktayı aşağı doğru iterek trigonal piramit geometrisine neden olur..
Aynısı görüntünün oktahedronunda da olabilir. İçinde tüm atomlar mümkün olan en kararlı şekilde ayrılır.
indeks
- 1 Bir atomun moleküler geometrisini önceden bilmek X?
- 2 Türleri
- 2.1 Doğrusal
- 2.2 Açısal
- 2.3 Tetrahedral
- 2.4 Trigonal Bipiramit
- 2.5 Octahedral
- 2.6 Diğer moleküler geometriler
- 3 Örnekler
- 3.1 Doğrusal geometri
- 3.2 Açısal geometri
- 3.3 Tetikleme planı
- 3.4 Tetrahedral
- 3.5 Trigonal piramit
- 3.6 trigonal Bipiramit
- 3.7 Salınım
- 3.8 T Şekli
- 3.9 Octahedral
- 4 Kaynakça
Bir atomun moleküler geometrisini önceden bilmek X?
Bunun için serbest elektron çiftlerini elektronik gruplar olarak düşünmek gerekir. Bunlar, atomlarla birlikte, atomik olarak bilinen şeyi tanımlayacaktır. elektronik geometri, moleküler geometrinin ayrılmaz bir yoldaşı.
Elektronik geometriden ve Lewis yapısı tarafından tespit edildikten sonra, serbest elektron çiftlerini moleküler geometrinin ne olacağını belirleyebiliriz. Tüm moleküler geometrilerin toplamı, küresel yapının ana hatlarını sağlayacaktır..
tip
Ana görüntüde görüldüğü gibi, moleküler geometri, merkezi atomu çevreleyen kaç atom sayısına bağlıdır. Bununla birlikte, eğer paylaşmadan bir çift elektron varsa, geometriyi değiştirir çünkü çok fazla hacim kaplar. Bu nedenle sterik bir etki gösterir..
Buna göre, geometri birçok molekül için bir dizi karakteristik şekil sunabilir. Ve bu, farklı moleküler geometri türlerinin veya moleküler yapının ortaya çıktığı yerdir..
Geometri yapıya ne zaman eşittir? Her ikisi de aynı şeyi yalnızca yapının birden fazla geometriye sahip olmadığı durumlarda gösterir; Aksi halde, mevcut tüm türler göz önünde bulundurulmalı ve genel bir ad verilen yapıya (doğrusal, dallı, küresel, düz, vb.).
Geometriler, bir katının yapısını yapısal birimlerinden açıklamak için özellikle yararlıdır.
doğrusal
Tüm kovalent bağlar yönsüzdür, bu nedenle A-B bağlantısı doğrusaldır. Fakat AB molekülü doğrusal olacak mı?2? Evetse, geometri basitçe şöyle temsil edilir: B-A-B. İki B atomu 180 ° 'lik bir açıyla ayrılır ve TEV'e göre, A'nın sp melez orbitalleri olmalıdır.
açısal
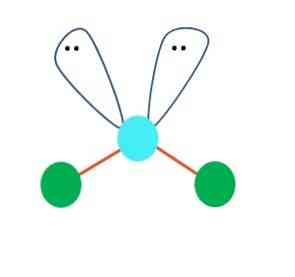
İlk örnekte AB molekülü için doğrusal bir geometri olduğu varsayılabilir.2; ancak, bir sonuca varmadan önce Lewis'in yapısını çizmek çok önemlidir. Lewis yapısını çizerek, paylaşmadan elektron çiftlerinin sayısını belirleyebilir (:) A atomu üzerinde.
Böyle olunca, elektron çiftlerinin tepesinde, B'nin iki atomunu aşağı doğru iterek açılarını değiştiriyorlar. Sonuç olarak, B-A-B doğrusal molekülü bir V, bir bumerang veya açısal bir geometri haline gelir (en iyi resim)
Su molekülü H-O-H, bu tip geometri için ideal bir örnektir. Oksijen atomunda, yaklaşık 109º bir açıyla yönlendirilmiş, paylaşımı olmayan iki çift elektron vardır..
Neden bu açı? Çünkü elektronik geometri dört köşeli tetrahedraldir: ikisi H atomu için, ikisi elektron için. Yukarıdaki resimde, yeşil noktaların ve iki “gözlü lobun” merkezde mavimsi noktası olan bir tetrahedron çizdiği görülüyor..
O'nun serbest elektron çiftleri olmasaydı, su doğrusal bir molekül oluşturur, kutupları düşer ve okyanuslar, denizler, göller vb. Muhtemelen bilindiği gibi mevcut olmazdı..
tetrahedral
Üstteki görüntü tetrahedral geometriyi temsil eder. Su molekülü için elektronik geometrisi dört yüzlüdür, ancak elektron içermeyen çiftleri ortadan kaldırarak açısal bir geometriye dönüştüğü fark edilebilir. Bu aynı zamanda iki yeşil noktayı ortadan kaldırarak da gözlenir; kalan iki V'yi mavi nokta ile çizer.
İki çift serbest elektron yerine sadece bir tane varsa? Sonra bir trigonal düzlem olurdu (ana görüntü). Bununla birlikte, bir elektronik grubun elimine edilmesiyle, serbest elektron çifti tarafından üretilen sterik etki önlenmez. Bu nedenle, trigonal düzlemi üçgen biçimli bir piramitle bozar:

Trigonal ve tetrahedral piramit moleküler geometrisi farklı olsa da, elektronik geometri aynıdır: tetrahedral. Yani trigonal piramit elektronik geometri olarak sayılmaz?
Cevap hayır, çünkü “gözlerle lob” un neden olduğu bozulma ve sterik etkisinin bir ürünüdür ve bu geometri daha sonraki bozulmaları dikkate almaz.
Bu nedenle, moleküler geometriyi tanımlamak için önce elektronik yapıların Lewis yapılarının yardımıyla belirlenmesi her zaman önemlidir. Amonyak molekülü, NH3, trigonal piramit moleküler geometrisinin bir örneği, ancak tetrahedral elektronik geometri ile.
Trigonal Bipiramit
Şimdiye kadar, doğrusal geometri hariç, tetrahedralde, açısal ve trigonal piramit, merkezi atomları sp hibridizasyona sahip3, TEV'e göre. Bu, eğer bağlantı açılarınız deneysel olarak belirlenirse, 109º civarında olması gerektiği anlamına gelir..
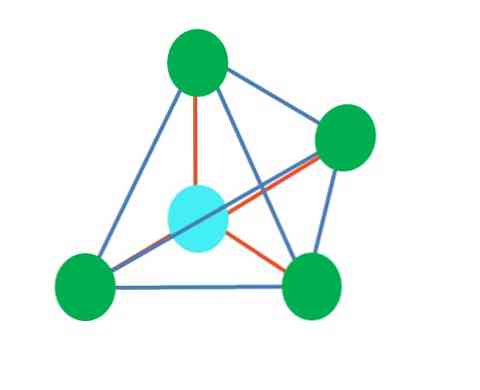
Trigonal dipiramidal geometride, merkezi atomun etrafında beş elektronik grup vardır. Üst resimde beş yeşil noktayla görebilirsiniz; Üçgen kaidede üç ve piramidin üst ve alt köşeleri olan iki eksenel konumda.
O zaman mavi nokta hangi hibridizasyona sahiptir? Basit bağları (turuncu) oluşturmak için beş hibrit yörüngeye ihtiyacı var. Bu, beş sp orbital ile sağlanır.3d (bir yörünge s, üç p ve a d karışımının ürünü).
Beş elektronik grup göz önüne alındığında, geometri zaten açığa çıkmıştır ancak paylaşmadan elektron çiftlerine sahipse, bu yine başka geometriler üreten çarpıklıklar çekmektedir. Ayrıca, aşağıdaki soru ortaya çıkar: Bu çiftler piramit içerisinde herhangi bir pozisyonda bulunabilir mi? Bunlar: eksenel veya ekvatoral.
Eksenel ve ekvatoral pozisyonlar
Üçgen tabanı oluşturan yeşil noktalar ekvator pozisyonda, ikisi ise alt ve üst uçlarda eksenel pozisyonlarda. Tercihen, paylaşılmayan elektron çifti nereye yerleştirilecek? Elektrostatik itme ve sterik etkiyi en aza indiren bu pozisyonda.
Eksenel pozisyonda elektron çifti üçgen taban üzerine dik olarak (90º) "basar", ekvator pozisyonda olsaydı, tabanın kalan iki elektronik grubu 120º ayrılır ve her iki ucunu da 90º basar (yerine üç, tabandaki gibi).
Bu nedenle, merkezi atom daha kararlı moleküler geometriler oluşturmak için elektron içermeyen çiftlerini ekvator pozisyonlarında yönlendirmeye çalışacaktır..
Salınım ve t şekli
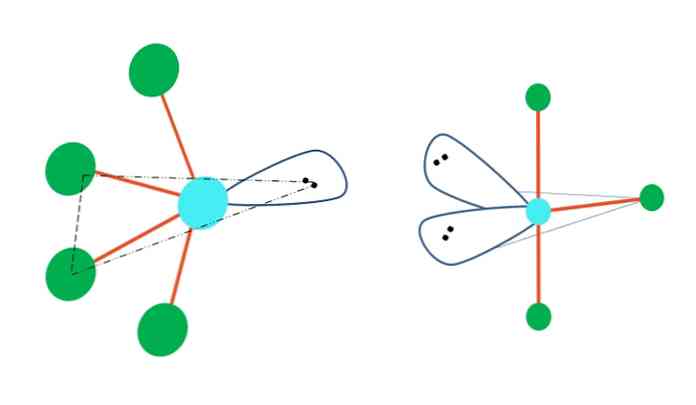
Trigonal bipramid geometrisi, atomlarından bir veya daha fazlasının elektron içermeyen çiftlerle değiştirilmesi durumunda, aynı zamanda farklı moleküler geometrilere sahip olacaktır..
Üst görüntünün solunda, geometri salınım şekline dönüşür. İçinde serbest elektron çifti, dört atomun geri kalanını aynı yönde iterek bağlantılarını sola katlar. Bu çiftin ve iki atomun, orijinal dipiramidin aynı üçgen düzleminde bulunduğunu unutmayın..
Ve görüntünün sağında, T şeklindeki geometri Bu moleküler geometri, iki elektronun yerine iki atom ikame edilmesinin sonucudur ve sonuç olarak kalan üç atomun, tam olarak bir harf çizen aynı düzlemde hizalanmasına neden olur. T.
Yani, AB tipi bir molekül için5, trigonal bipyramid geometrisini benimser. Ancak, AB4, Aynı elektronik geometri ile salınım geometrisini benimseyecektir; ve AB3, T şeklindeki geometri, hepsinde A (genellikle) sp hibridizasyona sahip olacaktır.3d.
Moleküler geometriyi belirlemek için Lewis yapısını ve dolayısıyla elektronik geometrisini çizmek gerekir. Eğer bu bir trigonal bipyramid ise, elektron içermeyen çiftler atılır, ancak atomların geri kalanı üzerindeki sterik etkileri olmaz. Böylece, üç olası moleküler geometri arasında mükemmel bir ayrım yapmak mümkündür..
sekiz yüzlü cisim
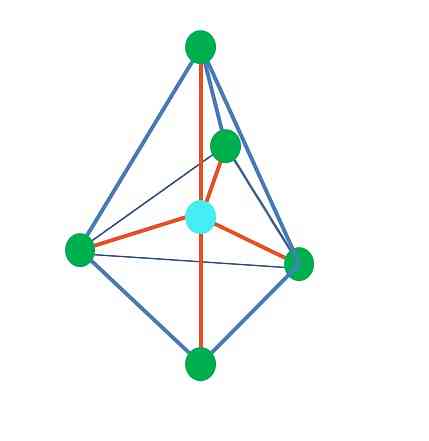
Oktahedral moleküler geometri, ana görüntünün sağında temsil edilir. Bu geometri türü AB bileşiklerine karşılık gelir6. AB4 kare kaideyi oluştururken, diğer iki B eksenel pozisyonlarda konumlandırılmıştır. Böylece, oktahedronun yüzleri olan birkaç eşkenar üçgen oluşur..
Burada, yine, (tüm elektronik geometrilerde olduğu gibi), serbest elektron çiftleri olabilir ve bu nedenle diğer moleküler geometriler, bu gerçeklerden kaynaklanır. Örneğin, AB5 oktahedral elektronik geometrisi ile kare kaideli bir piramit, ve AB4 kare düzlemde:
Oktahedral elektronik geometri için, bu iki moleküler geometri, elektrostatik itme açısından en stabil olanıdır. Kare-düzlem geometride, iki elektron çifti 180 ° aralıklıdır.
Bu geometrilerde atom A'nın hibridizasyonu nedir (veya tek ise yapıları)? Yine, TEV, sp olduğunu3d2, A'nın bir oktahedronun köşelerinde elektronik grupları yönlendirmesini sağlayan altı hibrit yörünge.
Diğer moleküler geometriler
Şimdiye kadar sözü edilen piramitlerin bazlarını değiştirerek, daha karmaşık bazı moleküler geometriler elde edilebilir. Örneğin, pentagonal bipyramid bir pentagona dayanır ve onu oluşturan bileşikler genel AB formülüne sahiptir.7.
Diğer moleküler geometriler gibi, B atomlarını da elektronsuz çiftler için ikame etmek, geometriyi diğer formlara bozacaktır.
Ayrıca, AB bileşikleri8 kare antiprizma gibi geometrileri benimseyebilirler. Bazı geometriler, özellikle AB formülleri için çok karmaşık olabilir7 ileri (AB’ye kadar)12).
Örnekler
Daha sonra, ana moleküler geometrilerin her biri için bir dizi bileşik belirtilecektir. Bir egzersiz olarak, tüm örnekler için Lewis yapılarını çizebilir ve elektronik geometri göz önüne alındığında moleküler geometrileri aşağıda listelenen şekilde elde edip edemediğinizi onaylayabilirsiniz..
Doğrusal geometri
-Etilen, H2C = CH2
-Berilyum klorür, BeCl2 (Cı-Be-CI)
-Karbondioksit, CO2 (O = C = O)
-Azot, N2 (N≡N)
-Merkür dibromid, HgBr2 (Br-Hg-Br)
-Anyon triiyodür, ben3- (I-l-I)
-Hidrojen siyanür, HCN (H-N≡C)
Açıları 180º olmalı ve bu nedenle sp hibridizasyonu olmalı..
Açısal geometri
-Su
-Sülfür dioksit, SO2
-Azot dioksit, NO2
-Ozon, O3
-Anyon amiduro, NH2-
Trigonal düzlem
-Brom triflorür, BF3
-Alüminyum triklorür, AlCl3
-Nitrat anyonu, NO3-
-Anyon karbonat, CO32-
tetrahedral
-Metan gazı, CH4
-Karbon tetraklorür, CCİ4
-Katyon amonyum, NH4+
-Anyon sülfat, SO42-
Trigonal piramit
-Amonyak, NH3
-Katyon hidroliği, H3Ey+
Trigonal Bipiramit
-Fosfor pentaflorür, PF5
-Antimon Pentaklorür, SbF5
titreşen
Sülfür tetraflorür, SF4
T şekli
-İyot triklorür, ICI3
-Klorür triflorür, ClF3 (her iki bileşik de interhalojenler olarak bilinir)
sekiz yüzlü cisim
-Sülfür heksaflorür, SF6
-Selenyum heksaflorür, SeF6
-Heksaflorofosfat, PF6-
Sonuç olarak, moleküler geometri maddenin kimyasal veya fiziksel özelliklerinin gözlemlerini açıklayan şeydir. Ancak, elektronik geometriye göre yönlendirilir, böylece ikincisi daima ilk önce belirlenmelidir..
referanslar
- Whitten, Davis, Peck ve Stanley. Kimya. (8. basım). CENGAGE Öğrenme, s 194-198.
- Shiver ve Atkins. (2008). İnorganik kimya (Dördüncü baskı, s. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Moleküler geometri ve VSEPR teorisi. Alınan: nyu.edu
- Sanal Chembook, Charles E. Ophardt. (2003). Moleküler Geometriye Giriş. Alınan kaynak: chemistry.elmhurst.edu
- Kimya LibreTexts. (8 Eylül 2016). Moleküllerin Geometrisi. Şu kaynaktan alındı: chem.libretexts.org


