Ziehl-Neelsen Leke Vakfı, Reaktifler ve Tekniği
Ziehl-Neelsen boyaması alkole aside dirençli mikroorganizmaları (AAR) tanımlamak için renklendirme tekniğinde. Bu mikrobiyoloji prosedürünün adı, yazarlarına atıfta bulunur: bakteriyolog Franz Ziehl ve patolog Friedrich Neelsen.
Bu teknik, gözlemlemek, ayırt etmek ve daha sonra tanımlamak istediğiniz yapılar arasında kontrast oluşturmak için farklı boyaların kullanımını ima eden bir tür farklı renklendirmedir. Ziehl-Neelsen boyası, bazı mikroorganizma tiplerini tanımlamak için kullanılır.
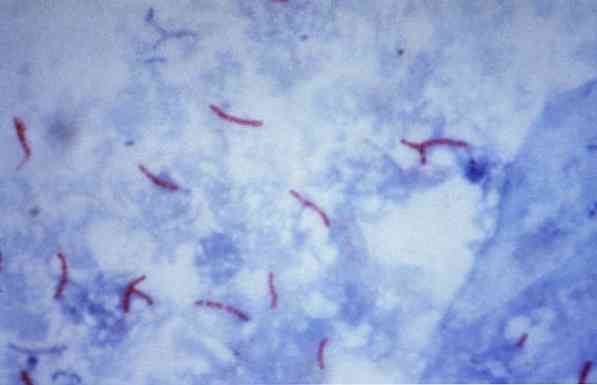
Bu mikroorganizmaların bazıları mikobakterilerdir (örneğin, Mycobacterium tuberculosis), nocardias (örneğin, Nocardia sp.) ve bazı tek hücreli parazitler (örneğin, Cryptosporidium parvum). Bakterilerin çoğu Gram boyası adı verilen ortak bir teknikle sınıflandırılabilir..
Bununla birlikte, bazı bakteri grupları, onları tanımlamak için başka yöntemler gerektirir. Ziehl-Neelsen boyaması gibi teknikler, ilk önce hücre duvarını sabitlemek için boya ile ısı kombinasyonunu gerektirir.
Sonra iki sonuç sağlayan bir renk değişikliği işlemi geliyor: asitler ve alkollerle renk bozulmasına karşı direnç veya duyarlılık.
indeks
- 1 Vakfı
- 1.1 İkincil renklendirme
- 2 Reaktifler
- 2.1 Ana renklendirme
- 2.2 Renk giderici çözelti
- 2.3 İkincil renklendirme (renklendirici önleyici)
- 3 Tekniği
- 3.1 Asit hızlı boyama prosedürü
- 4 Kaynakça
vakıf
Bu boyama tekniğinin temeli, bu mikroorganizmaların hücre duvarı özelliklerine dayanmaktadır. Duvar, mikolik asitler adı verilen bir tür yağ asidi tarafından oluşturulur; Bunlar çok uzun zincirlerle karakterize edilir.
Yağ asitleri çok uzun yapılara sahip olduğunda, boyaları daha kolay tutabilirler. Bazı bakteri türlerinin, hücre duvarının yüksek mikolik asit içeriği nedeniyle, Gram boyaması ile lekelenmesi çok zordur.
Ziehl-Neelsen boyasında, bazik bir boya olan fenolik bileşik carbol fuchsin kullanılır. Bu, oda sıcaklığında mumlu doku olan hücre duvarının yağ asitleri ile etkileşime girme kabiliyetine sahiptir.
Balbol fuchsin boyaması ısı varlığında iyileştirilir, çünkü balmumu erir ve boya molekülleri hücre duvarına daha hızlı hareket eder.
Daha sonra kullanılan asit, duvarları renklendiriciyle yeterince ilişkili olmadığı için lekelenmemiş hücrelerin rengini değiştirmeye hizmet eder; bu nedenle, asit çözücü maddenin gücü asit boyasını çıkarabilir. Bu renk bozulmasına direnen hücrelere aside dayanıklı denir.
İkincil boyama
Numunenin renk atmasından sonra, bu, ikincil boya olarak adlandırılan başka bir boya ile tezat teşkil eder. Metilen mavisi veya malakit yeşili genellikle kullanılır.
İkincil boya, arka plan malzemesini boyar ve sonuç olarak, birinci aşamada boyanan yapılara zıtlık yaratır. Sadece renksiz hücreler ikinci boyayı emer (lekelenmeyi önler) ve rengini alırlar, aside dirençli hücreler kırmızı rengi korurlar.
Bu prosedür sıklıkla tanımlanması için kullanılır. Mycobacterium tuberculosis ve Mycobacterium leprae, asit hızlı basil denilen.
reaktifler
Birincil renklendirme
Karboksin% 0,3 fuchsin (süzülmüş) kullanılır. Bu boya bir alkol karışımından hazırlanır: etanol (% 90) veya metanol (% 95) içindeki fenol ve bu karışımda 3 gram bazik fuşin çözülür.
Renk giderici çözelti
Bu adımda% 3 alkol asidi veya% 25 sülfürik asit çözeltileri kullanabilirsiniz.
İkincil renklendirme (renklendirici önleyici)
Numunelerde kontrastı yapmak için en yaygın kullanılan boya genellikle% 0.3 metilen mavisidir. Bununla birlikte,% 0.5 malakit yeşili gibi diğerleri de kullanılabilir..
teknik
Asit hızlı boyama prosedürü
Bakteriyel smear hazırlayın
Bu hazırlık sterilite önlemlerini takiben temiz ve kuru bir slayt üzerinde yapılır.
Smear kurutma
Leke oda sıcaklığında kurumaya bırakın.
Numuneyi ısıt
Örnek, aşağıdaki slayda ateş uygulanarak ısıtılmalıdır. Smear balgamla (henüz beyazlatmak için sodyum hipoklorit ile muamele edilmiş) hazırlanmadığında ve hemen boyanmayacaksa, alkol ile fiksasyon yapılabilir..
M. tüberkülozu Çamaşır suyu ile ve boyama işlemi sırasında elimine edilir. İşlenmemiş balgamın ısıyla sabitlenmesi öldürmez M. tüberkülozu, alkol ile fiksasyon bakterisit iken.
Leke örtmek
Leke, carbol fuchsin çözeltisi ile kaplanır (primer temel leke).
Lekeyi ısıt
Bu 5 dakika boyunca yapılır. Bir buhar salınımını fark etmelisiniz (yaklaşık 60 ° C). Numunenin aşırı ısınmaması ve yanmaması için önemlidir.
Lekenin ısınması ile ilgili olarak, fuchsin karabolunu ısıtırken, özellikle de boyama önceki tepsiden yüksek derecede yanıcı kimyasalların toplandığı bir tepsi veya başka bir kapta yapılırsa büyük özen gösterilmelidir..
Önceden birkaç damla asit alkol, metanol veya% 70 etanol ile nemlendirilmiş ışıklı bir çubuk kullanarak slaytların altına sadece küçük bir alev uygulanmalıdır. Etanolün içine batırılmış büyük bir bez kullanmaktan kaçının çünkü bu yangın tehlikesidir.
Leke yıkamak
Bu yıkama temiz suyla yapılmalıdır. Musluk suyu temiz değilse, lekeyi filtrelenmiş veya damıtılmış suyla, tercihen yıkayın.
Smear'i asit alkol ile örtün
Bu asit alkolü% 3 seviyesinde olmalıdır. Kapama 5 dakika boyunca veya smear yeterince renksiz hale gelene kadar, yani açık pembe.
Asit alkolün yanıcı olduğu dikkate alınmalıdır; bu nedenle, çok dikkatli kullanılmalıdır. Ateşleme kaynaklarına yakın olmaktan kaçının.
Leke yıkamak
Yıkama temiz ve saf su ile yapılmalıdır..
Boyayı boya ile ört
Smear incelirse en uzun süreyi kullanarak yeşil malakit (% 0.5) veya 1 veya 2 dakika metilen mavisi (% 0.3) boya olabilir.
Leke yıkamak
Temiz su tekrar kullanılmalı (damıtılmış).
akıtmak
Sürgünün arkası temizlenmeli ve leke drenaj rafına yerleştirilmeli, böylece havada kurutulur (kurutma için emici kağıt kullanmayın).
Smear mikroskobu inceleyin
100X hedefi ve daldırma yağı kullanılmalıdır. Smear'ı sistematik olarak tarayın ve ilgili gözlemleri yazın.
Sonuçları yorumla
Teorik olarak, kırmızımsı bir renkle boyanmış mikroorganizmaların asit-hızlı pozitif (AAR +) olduğu kabul edilir..
Aksine, mikroorganizmalar mavi veya yeşil lekelenmişse, bir karşı boya olarak kullanılan boyaya bağlı olarak negatif alkole dirençli asit (AAR-) olarak kabul edilirler..
referanslar
- Apurba, S. ve Sandhya, B. (2016). Pratik Mikrobiyolojinin Temelleri (1. basım). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Vücut Sistemine Göre Hastalıklar ile Mikrobiyoloji (4. basım). Pearson Education, Inc.
- Heritage, J., Evans, E. ve Killington, A. (1996). Giriş Mikrobiyolojisi (1. basım). Cambridge Üniversitesi Basını.
- Morello, J., Granato, P. Wilson, M. ve Morton, V. (2006). Mikrobiyolojide Laboratuvar Kitabı ve Çalışma Kitabı: Hasta Bakımına Uygulamalar (11. basım). McGraw-Hill Eğitim.
- Vasanthakumari, R. (2007). Mikrobiyoloji Ders Kitabı (1. basım). B.I. Yayınlar PVT.


