Karbon atomu özellikleri, yapı, hibridizasyon, sınıflandırma
karbon atomu Belki de tüm unsurların en önemlisi ve amblemidir, çünkü onun sayesinde yaşamın varlığı mümkündür. Sadece birkaç elektronu veya proton ve nötronları olan bir çekirdeği değil, aynı zamanda birleştirilen ve canlıları oluşturan yıldız tozunu da içine alır..
Ayrıca, yer kabuğunda karbon atomları bulunur, ancak demir, karbonatlar, karbon dioksit, yağ, elmaslar, karbonhidratlar, vb. Gibi metalik elementlerle karşılaştırılabilir bir bolluğa sahip olmamasına rağmen fiziksel ve kimyasal belirtileri.
Peki karbon atomu nasıl? İlk yanlış çizim, yukarıdaki resimde özellikleri gözlemlenen ve özellikleri aşağıdaki bölümde açıklanan çizimdir..
Karbon atomları atmosferde, denizlerde, alt topraklarda, bitkilerde ve herhangi bir hayvan türünde hareket eder. Büyük kimyasal çeşitliliği, bağlantılarının yüksek stabilitesinden ve uzayda nasıl sıralandıklarından kaynaklanmaktadır. Böylece bir yandan pürüzsüz ve yağlayıcı grafite sahiptir; ve diğer taraftan, sertliği birçok malzemeninkinden daha yüksek olan elmas.
Karbon atomu onu niteleyen niteliklere sahip olmasaydı, organik kimya tam olarak mevcut olmazdı. Bazı vizyonerler, allotropik yapılarının (karbon nanotüpler, grafen, fullerenler, vb.) Tasarımı ve işlevselliği yoluyla geleceğin yeni materyallerini görüyorlar..
indeks
- 1 Karbon atomunun özellikleri
- 2 yapı
- 3 Hibridizasyon
- 3.1 sp3
- 3.2 sp2 ve sp
- 4 Sınıflandırma
- 4.1 Birincil
- 4.2 İkincil
- 4.3 Üçüncül
- 4.4 Kuaterner
- 5 kullanır
- 5.1 Atomik kütle birimi
- 5.2 Karbon döngüsü ve yaşam
- 5.3 13C NMR spektroskopisi
- 6 Kaynakça
Karbon atomunun özellikleri
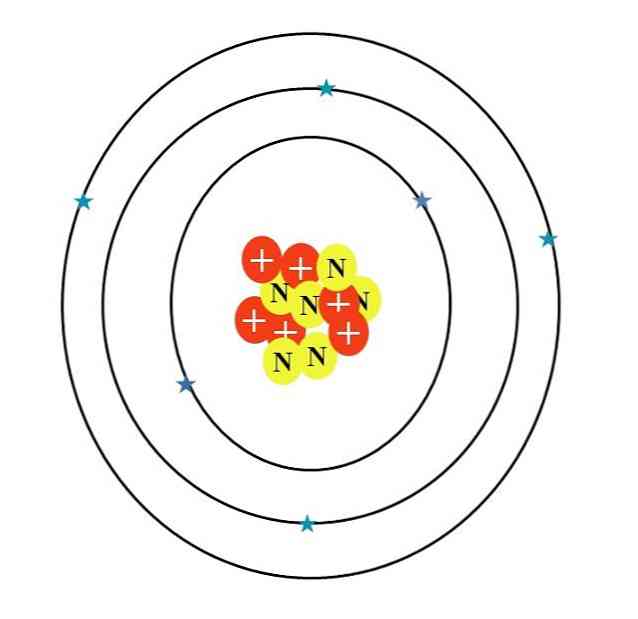
Karbon atomu C harfi ile sembolize edilmiştir. Atom numarası Z 6'dır, bu nedenle altı protonu vardır (çekirdekte "+" sembolü olan kırmızı daireler). Ayrıca, altı nötron ("N" harfli sarı daireler) ve son olarak altı elektron (mavi yıldızlar) vardır..
Atomik parçacıklarının kütlelerinin toplamı, 12.0107u ortalama değer verir. Bununla birlikte, görüntüdeki atom 12-karbon izotopuna karşılık gelir (12C), d. Diğer izotoplar, örneğin 13C ve 14C, az miktarda bulunur, sadece nötron sayısında değişir.
Yani, eğer bu izotopları çizersen 13C ek bir sarı daireye sahip olacaktı ve 14C, iki tane daha. Bu mantıksal olarak daha ağır karbon atomları oldukları anlamına gelir.
Buna ek olarak, bu konuda başka hangi özelliklerden bahsedilebilir? Dört değerlidir, yani dört kovalent bağ oluşturabilir. Periyodik tablonun Grup 14'te (KDV), daha özel olarak p bloğunda bulunur..
Aynı zamanda, periyodik tablonun hemen hemen tüm unsurları ile bağlantı kurabilen çok yönlü bir atomdur; özellikle kendisiyle, makromoleküller ve doğrusal, dallanmış ve lameller polimerleri oluşturur..
yapı
Bir karbon atomunun yapısı nedir? Bu soruyu cevaplamak için önce elektronik yapılandırmanıza gitmelisiniz: 1s22s22p2 veya [He] 2s22p2.
Bu nedenle, üç yörünge vardır: 1'ler2, 2'ler2 ve 2p2, her biri iki elektronludur. Bu, yukarıdaki resimde de görülebilir: her birinde iki elektronlu (mavi yıldız) üç halka (halkaları yörüngelerle karıştırmayın: yörüngeler).
Bununla birlikte, yıldızların ikisinin diğer dörtten daha koyu bir maviye sahip olduğunu unutmayın. Neden? Çünkü ilk ikisi, iç tabakaya 1s karşılık gelir.2 veya doğrudan kimyasal bağların oluşumuna katılmayan [He]; dış tabakadaki elektronlar, 2s ve 2p,.
S ve p orbitalleri aynı şekle sahip değildir, bu nedenle gösterilen atom gerçekliğe göre değildir; Elektronlar ve çekirdek arasındaki mesafenin büyük ölçüde orantısız olmasına ek olarak, yüzlerce kat daha büyük olmalıdır.
Bu nedenle, karbon atomunun yapısı, elektronların dağınık elektronik bulutlarda "eridiği" üç yörüngeden oluşur. Çekirdek ve bu elektronlar arasında atomun içindeki büyük "boşluk" u anlamamızı sağlayan bir mesafe var..
melezleme
Daha önce, karbon atomunun dört değerli olduğu belirtildi. Elektronik yapılandırmasına göre, 2s elektronları eşleştirilmiş ve 2p elektronları eşleştirilmemiş:
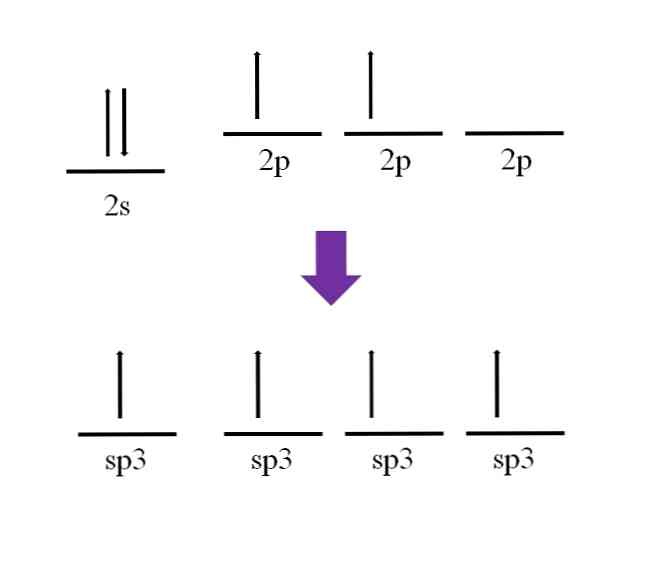
Boş ve azot atomunda ilave bir elektron ile doldurulmuş olan mevcut bir p orbital kalmıştır (2 p3).
Kovalent bağ tanımına göre, her bir atomun oluşumu için bir elektrona katkıda bulunması gerekir; Bununla birlikte, bazal durum karbon atomunun zarında ancak iki eşlenmemiş elektron vardır (her 2p orbitalinde bir tane). Bu, bu durumda iki değerli bir atom olduğu ve bu nedenle sadece iki bağ oluşturduğu anlamına gelir (-C-).
Peki, karbon atomunun dört bağ oluşturması nasıl mümkün olabilir? Bunu yapmak için, 2s orbitalinden 2p yüksek enerji orbitaline kadar bir elektronu teşvik etmelisiniz. Bu yapılır, sonuçta ortaya çıkan dört orbital dejenere; Başka bir deyişle, aynı enerjiye veya dengeye sahipler (hizalandıklarına dikkat edin).
Bu işlem hibridizasyon olarak bilinir ve bu sayede karbon atomunun dört tane yörünge sp özelliği vardır.3 Her biri bir elektron ile dört bağlantı oluşturur. Bu, dört değerli olma özelliği nedeniyle.
sp3
Karbon atomu bir sp hibridizasyona sahip olduğunda3, Dört hibrit yörüngesini elektronik geometrisi olan tetrahedronun köşelerine yönlendirin.
Yani, bir karbon sp tanımlayabilirsiniz3 çünkü metan molekülünde olduğu gibi sadece dört basit bağ oluşturur (CH4). Ve bunun etrafında bir dört yüzlü ortam gözlemlenebilir.
Sp orbitallerinin üst üste binmesi3 basit C-C bağının entalpi 345.6 kJ / mol olacağı kadar etkili ve kararlıdır. Bu, neden sonsuz karbonlu yapıların ve ölçülemez sayıdaki organik bileşiklerin olduğunu açıklar. Buna ek olarak, karbon atomları diğer bağ türlerini oluşturabilir.
sp2 ve sp
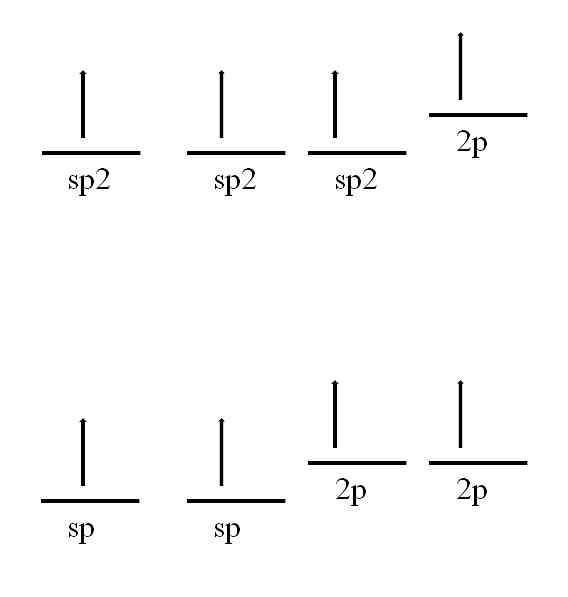
Karbon atomu ayrıca çift veya üçlü bir bağ oluşturmasını sağlayacak olan başka hibritleşmeleri benimseyebilir..
Sp hibridizasyonunda2, Resimde görüldüğü gibi, üç sp orbital vardır2 dejenere olmuş ve 2p'lik bir orbital değişmemiş veya "saf" kalmıştır. Üç sp yörüngeli2 120 ° ayrık, karbon bir trigonal düzlem elektronik geometrisi çizerek üç kovalent bağ oluşturur; 2p orbital ile, diğer üçüne dik iken, bond: -C = C-.
Sp hibridizasyonu durumunda, lineer bir elektronik geometri çizmeleri için 180 separated ayrılmış iki sp orbital vardır. Bu sefer, karbonun üçlü bağlar ya da iki çift bağ oluşturmasına izin veren, birbirine dik olan iki saf 2p yörüngeye sahiptirler: ).
Her zaman (genellikle) karbonun etrafına bağlantılar eklerseniz, sayının dörde eşit olduğunu göreceksiniz. Lewis yapıları veya moleküler yapıları çizerken bu bilgi gereklidir. Beş bağ oluşturan bir karbon atomu (= C≡C) teorik ve deneysel olarak kabul edilemezdir..
sınıflandırma
Karbon atomları nasıl sınıflandırılır? İç özelliklere göre yapılan bir sınıflandırmadan daha fazlası, gerçeğe moleküler ortama bağlıdır. Bir molekül içerisinde karbon atomlarının aşağıdakilere göre sınıflandırılabildiği söylenebilir..
birincil
Bir birincil karbon, yalnızca başka bir karbona bağlı olan bir karbondur. Örneğin, etan molekülü, CH3-CH3 iki bağlı primer karbondan oluşur. Bu bir karbon zincirinin sonunu veya başlangıcını gösterir.
ikincil
İki karbona bağlı olanıdır. Yani, propan molekülü için, CH3-CH2-CH3, besiyerinin karbon atomu ikincildir (metilen grubu, -CH2-).
üçüncü
Üçüncül karbonlar diğerlerinden farklıdır, çünkü onlardan ana zincirin dalları ortaya çıkar. Örneğin, 2-metilbütan (izopentan olarak da bilinir), CH3-CH(CH3) -CH2-CH3 Koyu renkle vurgulanmış üçüncül bir karbonu vardır..
dörtlü
Son olarak, kuaterner karbonları, adından da anlaşılacağı gibi, diğer dört karbon atomu ile bağlantılıdır. Neopentan molekülü, C(CH3)4 kuaterner bir karbon atomuna sahip.
uygulamaları
Atom kütlesi birimi
Ortalama atom kütlesi 12Diğer elementlerin kütlelerinin hesaplanmasında standart bir ölçü olarak C kullanılmıştır. Bu nedenle hidrojen, neyin bilindiğini tanımlamak için kullanılan bu karbon izotopunun onik bir ağırlığına sahiptir. atomik kütle birimi u.
Böylece, diğer atomik kütleler ... 12C ve 1H. Örneğin, magnezyum (24Mg) bir karbon atomundan iki kat daha ağır ve bir hidrojen atomundan 24 kat daha ağırdır.
Karbon döngüsü ve yaşam
Bitkiler CO absorbe eder2 fotosentez sürecinde atmosfere oksijen salıvermek ve bitki ciğerleri gibi hareket etmek. Öldüklerinde, yandıktan sonra CO salgılayan kömür haline gelirler.2. Bir kısmı bitkilere geri döner, ancak bir diğeri deniz yataklarında biter ve birçok mikroorganizmayı besler.
Mikroorganizmalar öldüğü zaman, biyolojik olarak ayrışan çökeltilere kalan katı ve milyonlarca yıl sonra, yağ olarak bilinen şeye dönüşür..
İnsanlık bu yağı kömürün yakılması için alternatif bir enerji kaynağı olarak kullandığında, daha fazla CO salınımına katkıda bulunur.2 (ve diğer istenmeyen gazlar).
Öte yandan, yaşam, en temellerinden karbon atomlarını kullanır. Bu, DNA gibi önemli makromolekülleri oluşturan zincirleri ve moleküler yapıları oluşturmasını sağlayan bağlarının kararlılığından kaynaklanmaktadır..
NMR spektroskopisi 13C
13C, olduğundan daha küçük bir oranda olmasına rağmen 12C, bolluğu, karbon-13 nükleer manyetik rezonans spektroskopisi yoluyla moleküler yapıları aydınlatmak için yeterlidir..
Bu analiz tekniği sayesinde, hangi atomların çevreyi sardığı tespit edilebilir. 13C ve hangi fonksiyonel gruplara ait oldukları. Böylece herhangi bir organik bileşiğin karbon iskeleti belirlenebilir.
referanslar
- Graham Solomons T.W., Craig B. Fryhle. Organik Kimya Aminler. (10. baskı.) Wiley Plus.
- Blake D. (4 Mayıs 2018). Karbonun Dört Özellikleri. Şu kaynaktan alındı: sciencing.com
- Kraliyet Kimya Derneği. (2018). Karbon. Alındığı kaynak: rsc.org
- Evrimi Anlamak. (N.D.). Bir karbon atomunun yolculuğu. Alındığı kaynak: evolution.berkeley.edu
- Ansiklopedi Britannica. (14 Mart 2018). Karbon. Alınan: britannica.com
- Pappas S. (29 Eylül 2017). Karbon Hakkında Gerçekler. Alınan: livescience.com


