Gümüş sülfit (Ag2S) yapısı, özellikleri, adlandırılması, kullanımları
gümüş sülfür Kimyasal formülü Ag olan inorganik bir bileşiktir.2S. Ag katyonlarının oluşturduğu siyah grimsi bir katıdan oluşur.+ ve anyonlar S2- 2: 1 oranında. S2- Ag'a çok benziyor+, çünkü her ikisi de yumuşak iyonlardır ve birbirleriyle stabilize olmayı başarırlar..
Gümüş takılar, karakteristik parlaklıklarını yitirerek kararma eğilimindedir. Renk değişimi, gümüşün oksidasyonunun bir ürünü değil, düşük konsantrasyonlarda ortamda bulunan hidrojen sülfit ile reaksiyonundan; Bu, kükürt bakımından zengin bitkilerin, hayvanların veya yiyeceklerin çürümesinden veya bozulmasından kaynaklanabilir..

H2Molekülü bir sülfür atomu taşıyan S, aşağıdaki kimyasal eşitliğe göre gümüş ile reaksiyona girer: 2Ag (s) + H2S (g) => Ag2S (s) + H2(G)
Bu nedenle, Ag2Gümüş üzerinde oluşan siyah tabakalardan S sorumludur. Bununla birlikte, doğada bu kükürt ayrıca akantita ve argentita minerallerinde de bulunabilir. İki mineral, üst görüntüdeki katı gibi siyah ve parlak kristalleriyle diğerlerinden ayırt edilir..
Ag2S polimorfik yapılar, çekici elektronik ve optoelektronik özellikler sunar, yarı iletkendir ve güneş pilleri gibi fotovoltaik cihazların geliştirilmesinde malzeme olacağa söz verir..
indeks
- 1 yapı
- 2 Özellikler
- 2.1 Moleküler ağırlık
- 2.2 Görünüm
- 2.3 Koku
- 2.4 Erime noktası
- 2.5 Çözünürlük
- 2.6 Yapı
- 2.7 Kırılma indisi
- 2.8 Dielektrik sabiti
- 2.9 Elektronik
- 2.10 Azaltma reaksiyonu
- 3 İsimlendirme
- 3.1 Sistematik
- 3.2 Stok
- 3.3 Geleneksel
- 4 Kullanım
- 5 Kaynakça
yapı
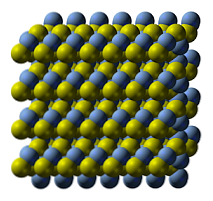
Gümüş sülfitin kristalli yapısı üstteki resimde gösterilmektedir. Mavi küreler Ag katyonlarına karşılık gelir+, sarı olanlar anyonlara S2-. Ag2S polimorfiktir, yani belirli sıcaklık koşulları altında birkaç kristalli sistemi benimseyebileceği anlamına gelir.
Nasıl? Faz geçişi yoluyla. İyonlar, sıcaklıktaki artış ve katının titreşimleri, elektrostatik çekim-itme dengesini bozmayacak şekilde yeniden düzenlenir. Bu olduğunda, bir faz geçişi olduğu söylenir ve bu nedenle katı yeni fiziksel özellikler gösterir (parlaklık ve renk gibi).
Ag2Normal sıcaklıklarda (179ºC'den düşük) S, monoklinik bir kristal yapıya sahiptir (α-Ag2G). Bu katı fazın yanı sıra iki tane daha var: 179 - 586 cubC arasında bcc (vücutta ortalanmış küp) ve çok yüksek sıcaklıklarda fcc (yüzlerde ortalanmış küp) (Ag- Ag2S).
Argentit minerali, β-Ag olarak da bilinen fcc fazından oluşur.2S. Bir kez soğutulur ve bir uçurum haline dönüştürülür, yapısal özellikleri bir araya gelir. Bu nedenle, her iki kristal yapı da bir arada bulunur: monoklinik ve bcc. Böylece, parlak ve ilginç ton taşlarıyla siyah katılar ortaya çıkıyor..
özellikleri
Moleküler ağırlık
247.80 g / mol
görünüm
Grimsi siyah kristaller
koku
tuvalet.
Erime noktası
836ºC. Bu değer, Ag’nin2S, az iyonik karakterli bir bileşiktir ve bu nedenle 1000ºC'nin altındaki sıcaklıklarda erir..
çözünürlük
Suda sadece 6,21 ∙ 10-15 25 ° C'de g / L. Yani, çözündürülen siyah katı miktarı ihmal edilebilir düzeydedir. Bu, yine, Ag-S bağının küçük kutupsal karakterinden kaynaklanmaktadır, ki burada her iki atom arasında elektronegatiflik farkı yoktur.
Ayrıca, Ag2S tüm çözücülerde çözünmez. Hiçbir molekül kristalin katmanlarını Ag iyonlarında etkin bir şekilde ayıramaz.+ ve S2- solvatlanmış.
yapı
Dört kat S-Ag-S bağı da, katı madde anlayışa maruz kaldığında birbirleri üzerinde hareket eden yapı görüntüsünde görülebilir. Bu davranış, yarı iletken olmasına rağmen, oda sıcaklığında birçok metal gibi yumuşak olduğu anlamına gelir.
S-Ag-S katmanları, zikzak olarak görülen açısal geometrileri nedeniyle uygun bir şekilde oturmaktadır. Bir anlama gücü olan, bunlar bir yer değiştirme ekseni üzerinde hareket eder ve böylece gümüş ve kükürt atomları arasında yeni kovalent olmayan etkileşimlere neden olurlar..
Kırılma indeksi
2.2
Dielektrik sabiti
6
elektronik
Ag2S bir amfoterik yarı iletkendir, yani, sanki tipindeymiş gibi davranır n ve türün p. Aynı zamanda kırılgan değildir, bu nedenle elektronik cihazlarda kullanımı için çalışılmıştır..
Azaltma reaksiyonu
Ag2Siyah parçaları sıcak su, NaOH, alüminyum ve tuzla yıkayarak metalik gümüşe düşürülebilir. Aşağıdaki reaksiyon gerçekleşir:
3AG2S (ler) + 2Al (s) + 3H2O (l) => 6Ag (s) + 3H2S (ac) + Al2Ey3(S)
terminoloji
Elektronik yapılandırması [Kr] 4d olan Silver105S1, sadece bir elektronu kaybedebilir: en dıştaki yörüngesindeki 5'ler. Böylece, Ag katyon+ elektronik konfigürasyonda kalır [Kr] 4d10. Bu nedenle, bileşiklerinin nasıl çağrılması gerektiğini belirleyen benzersiz bir + 1 değerine sahiptir..
Öte yandan, kükürt elektronik yapılandırmaya sahiptir [Ne] 3s23p4, ve değerlik oktetini tamamlamak için iki elektrona ihtiyaç duyar. Bu iki elektronu (gümüşden) kazandığında, kükürt anyonuna dönüşür, S2-, [Ar] yapılandırması ile. Yani, argon asil gazı izoelektroniktir..
Yani bu Ag2S aşağıdaki isimlendirmelere göre çağrılmalıdır:
Sistematiği
maymunsülfit diGümüş. Burada her bir elementin atom sayısını göz önünde bulunduruyoruz ve Yunanca numaralayıcıların ön ekleri ile gösteriliyor..
stok
Gümüş sülfür Eşsiz bir + 1 değerine sahipken, parantez içindeki Romen rakamlarıyla belirtilmez: gümüş sülfit (I); hangisi yanlış.
geleneksel
Sulfuro tartışmasıico. Gümüş +1 değerinde "işlediğinden", -ico eki adına eklenir Argentum Latince.
uygulamaları
Ag'nin yeni kullanımlarından bazıları2S aşağıdakilerdir:
-Nanoparçacıklarının (farklı ebatlarda) solüsyon renklendirmeleri antibakteriyel aktiviteye sahiptir, toksik değildir ve bu nedenle tıp ve biyoloji alanlarında kullanılabilir..
-Onların nanoparçacıkları, kuantum noktaları olarak bilinen şeyi oluşturabilir. Bunlar, birçok organik flüoresan molekülden daha fazla yoğunluğa sahip radyasyonu emer ve yayar;.
-Α-Ag'in yapıları2Güneş pili olarak kullanılmak üzere çarpıcı elektronik özellikler sergiler. Aynı zamanda yeni termoelektrik malzemelerin ve sensörlerin sentezi için bir başlangıç noktasıdır..
referanslar
- Mark Peplow. (17 Nisan 2018). Yarı iletken gümüş sülfit metal gibi esner. Alındığı kaynak: cen.acs.org
- İşbirliği: III / 17E-17F-41C () Gümüş sülfit (Ag2S) kristal yapısının hacminin yazarları ve editörleri. In: Madelung O., Rössler U., Schulz M. (eds) Tetrahedrally Gümrüklü Elementler ve İkili Bileşikler I. Landolt-Börnstein - Grup III Yoğun Madde (Bilim ve Teknolojide Sayısal Veri ve İşlevsel İlişkiler), cilt 41C. Springer, Berlin, Heidelberg.
- Vikipedi. (2018). Gümüş sülfür Alındığı kaynak: en.wikipedia.org
- Stanislav I. Sadovnikov ve col. (Temmuz 2016). Ag2S gümüş sülfit nanoparçacıkları ve kolloidal çözeltiler: Sentez ve özellikleri. Alındığı kaynak: sciencedirect.com
- Azo Malzemeleri. (2018). Gümüş Sülfür (Ag2S) Yarıiletkenler. Alındığı kaynak: azom.com
- A. Nwofe. (2015). Gümüş sülfit ince filmlerin beklentileri ve zorlukları: Bir derleme. Malzeme Bilimi ve Yenilenebilir Enerji Anabilim Dalı, Endüstriyel Fizik Bölümü, Ebonyi Eyalet Üniversitesi, Abakaliki, Nijerya.
- UMassAmherst. (2011). Ders Gösteri: kararmış gümüşü temizleme. Alındığı kaynak: lecturedemos.chem.umass.edu
- Çalışma. (2018). Gümüş Sülfür Nedir? - Kimyasal Formül ve Kullanım Alanları. Alındığı kaynak: study.com


