İkili Yer Değiştirme Reaksiyon Türleri ve Örnekleri
çift ikame reaksiyonu, İkili yer değiştirme veya metatez, bunlardan herhangi biri oksitlenmeden veya indirgenmeden iki bileşik arasında çift iyon değişiminin gerçekleştiğidir. En temel kimyasal reaksiyonlardan biridir.
Yeni bağlar, iyonlar arasındaki büyük elektrostatik çekim kuvvetleri tarafından oluşturulur. Ayrıca, reaksiyon esas olarak su molekülü gibi daha kararlı türlerin oluşumunu desteklemektedir. Çift ikame reaksiyonu için genel kimyasal denklem, aşağıdaki resimde gösterilmektedir..
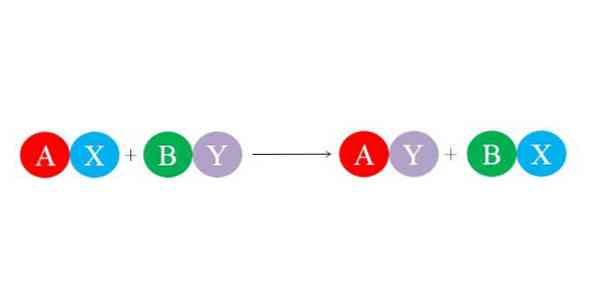
İlk bileşikler AX ve BY, "partnerleri" alış verişiyle reaksiyona girerek iki yeni bileşik oluşturur: AY ve BX. Bu reaksiyon, yalnızca A ve Y, A ve B'den daha fazla ilişkiliyse veya BX bağlantıları BY'ninkilerden daha stabil ise meydana gelir. Reaksiyon basit bir iyon değişimi olduğundan, bunların hiçbiri elektron kazanmaz veya kaybetmez (redoks reaksiyonu).
Bu nedenle, eğer A, AX bileşiğindeki bir yük katyonu + 1 ise, AY bileşiğinde aynı yük + 1'e sahip olacaktır. Aynısı "mektupların" geri kalanı için de geçerli. Bu reaksiyon tipi asit-baz reaksiyonların ve çökelti oluşumunun desteğidir.
indeks
- 1 Türleri
- 1.1 Nötralizasyon
- 1.2 Yağış
- 2 Örnekler
- 2.1 Örnek 1
- 2.2 Örnek 2
- 2.3 Örnek 3
- 2.4 Örnek 4
- 2.5 Örnek 5
- 2.6 Örnek 6
- 2.7 Örnek 7
- 2.8 Örnek 8
- 3 Kaynakça
tip
karşı koyma
Güçlü bir asit, çözünür tuzlar ve su üretmek için güçlü bir bazla reaksiyona girer. İkisinden biri - asit veya baz - zayıf olduğunda, üretilen tuz tamamen iyonize değildir; yani, hidroliz yapabilen sulu bir ortamda. Aynı şekilde, asit veya baz bir tuzla nötrleştirilebilir.
Yukarıdakiler yine AXBY harfleri ile kimyasal denklem ile gösterilebilir. Ancak, Brønsted asitliği sadece H iyonları tarafından gösterildiğinden+ ve OH-, bunlar daha sonra A ve Y harflerini temsil eder:
HX + BOH => HOH + BX
Bu kimyasal denklem, HH (H) üretmek için bir HX asidi ve bir BOH bazı arasındaki reaksiyon olan sadece nötrleşmeye tekabül eder.2O) ve suda çözünür veya çözünür olmayan BX tuzu.
İskeletiniz stokiyometrik katsayılara veya asidin yapısına göre değişebilir (organik veya inorganik).
çökeltme
Bu tip reaksiyonda, ürünlerden biri ortam içinde çözünmez, genellikle sulu ve çökeltiler (katı, çözeltinin geri kalanından katılaşır).
Şema aşağıdaki gibidir: iki çözünür bileşik, AX ve BY karıştırılır ve ürünlerden biri olan AY veya BX, çözünürlük kurallarına bağlı olacak şekilde çökelir:
AX + BY => AY (lar) + BX
AX + BY => AY + BX (ler)
Hem AY hem de BX'in suda çözünmez olması durumunda, en güçlü elektrostatik etkileşimleri sergileyen bu iyon çifti, çözünürlük sabitlerine (Kps) kantitatif olarak yansıtılabilen çökeltici olacaktır..
Bununla birlikte, çoğu çökelme reaksiyonunda, bir tuz çözünür, diğer çökeltiler. Hem reaksiyonlar-nötrleştirme hem de çökeltme- aynı madde karışımında oluşabilir.
Örnekler
Örnek 1
HC1 (ac) + NaOH (ac) => H20 (l) + NaCl (ac)
Bu ne biçim bir tepki? Hidroklorik asit, sonuç olarak su ve sodyum klorür üreten, sodyum hidroksit ile reaksiyona girer. NaCl sulu ortamda çok çözünür olduğu ve bir su molekülü de oluştuğu için, örnek l'deki reaksiyon nötrleştirmedir..
Örnek 2
Cu (NO3)2(ac) + Na2S (ac) => CuS + 2NaNO3(Sulu)
Bu reaksiyonda H iyonu yoktur+ ne de OH-, ve su molekülü kimyasal denklemin sağ tarafında gözlenmedi.
Bakır (II) nitrat veya kuprik nitrat, iyonları sodyum sülfit ile değiştirir. Bakır sülfit, çözünmeyen, sodyum nitratın aksine, çözünen tuzun çözünmez.
Cu (NO) çözeltisi3)2 mavi iken, Na2S sarımsıdır. Her ikisi de karıştırıldığında renkler kaybolur ve siyahımsı bir katı olan CuS çöker..
Örnek 3
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
Yine, bu başka bir nötralizasyon reaksiyonudur. Asetik asit, sodyum asetat tuzu ve bir su molekülü oluşturmak için sodyum hidroksit ile reaksiyona girer..
Örnek 1'den farklı olarak, sodyum asetat anyon hidrolize edildiğinden tamamen iyonize olan bir tuz değildir:
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(Sulu)
Örnek 4
2HI (ac) + CaCO3(s) => H2CO3(ac) + CaI2(Sulu)
Nötrleştirici görünmese de, bu reaksiyonda hidriodik asit karbonik asit ve kalsiyum iyodür üretmek için kireçtaşı ile tamamen reaksiyona girer. Ek olarak, ısı salınımı (ekzotermik reaksiyon) karbonik asidi karbon dioksit ve suya ayrıştırır:
'H2CO3(ac) => CO2(g) + H2O (l)
Küresel tepki şu şekilde kalıyor:
2HI (ac) + CaCO3(s) => CO2(g) + H2O (l) + CaI2(Sulu)
Ayrıca, kalsiyum karbonat, baz tuzu, hidriodik asidi nötralize eder.
Örnek 5
AgNO3(ac) + NaCl (ac) => AgCl (ler) + NaNO3(Sulu)
Gümüş nitrat iyonları sodyum klorürle değiştirir, böylece gümüş klorürün (beyazımsı çökelti) ve sodyum nitratın çözünmeyen tuzunu oluşturur.
Örnek 6
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (l) + Ca3(PO4)2(S)
Fosforik asit kalsiyum hidroksit ile nötrleştirilir, sonuç olarak çözünmez tuz kalsiyum fosfat ve altı mol su molekülü oluşur..
Bu, her iki tipte bir çift ikame reaksiyonunun bir örneğidir: asidin nötrleştirilmesi ve çözünmeyen bir tuzun çökeltilmesi.
Örnek 7
K2S (ac) + MgSO4(ac) => K2GB4(ac) + MgS (ler)
Potasyum sülfit magnezyum sülfat ile reaksiyona girer, iyonlar çözelti içinde bir araya gelirler2- ve Mg2+ çözünmeyen tuz magnezyum sülfit ve çözünür tuz potasyum sülfatın oluşturulması.
Örnek 8
na2S (ac) + HC1 (ac) → NaCl (ac) + H2S (g)
Sodyum sülfit hidroklorik asidi nötrleştirir, sodyum klorür ve hidrojen sülfür üretir.
Bu reaksiyonda su (en yaygın nötralizasyonların aksine) değil, çürük yumurta kokusu çok hoş olmayan elektrolitik olmayan hidrojen sülfür molekülü oluşur. H2S çözündürmeyi gaz halinde bırakır ve türlerin geri kalanı çözünmüş kalır.
referanslar
- Whitten, Davis, Peck ve Stanley. Kimya. (8. basım). CENGAGE Öğrenme, p 150-155.
- Quimicas.net (2018). İkili Değiştirme Reaksiyonuna Örnekler. Quimicas.net'ten 28 Mayıs 2018 tarihinde alındı
- Metatez Reaksiyonları. 28 Mayıs 2018'de, şu kaynaktan alındı: science.uwaterloo.ca
- Khan Akademisi. (2018). Çift değiştirme reaksiyonları. 28 Mayıs 2018'de alınan: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (8 Mayıs 2016). Çift Yedek Reaksiyon Tanımlaması. 28 Mayıs 2018'de alındı, nereden: thoughtco.com


