Raoult Yasası İçerisinde Olumlu ve Olumsuz Sapmalar
Raoult kanunu Fransız kimyacı François-Marie Raoult tarafından 1887'de önerildi ve bu buluşta mevcut her bir bileşenin kısmi buhar basıncına bağlı olarak iki karışabilir madde çözeltisinin (tipik olarak ideal) buhar basıncının davranışını açıklamaya hizmet ediyor.
Bilimsel olarak kanıtlanmış matematiksel modeller kullanarak maddelerin farklı koşullardaki davranışlarını tanımlamak ve dahil oldukları fenomenleri açıklamak için kullanılan kimya yasaları vardır. Raoult yasası bunlardan biridir.

Buhar basınçlarının davranışını tahmin etmek için gaz molekülleri (veya sıvılar) arasındaki etkileşimlere dayanan bir açıklama kullanarak, bu yasa, gerekli katsayıların modeli düzeltmek için düşünüldüğü düşünüldüğünde, ideal olmayan veya gerçek çözümleri incelemek için kullanılır. matematiksel ve ideal olmayan koşullara ayarlamak.
indeks
- 1 Ne içerir??
- 2 Olumlu ve olumsuz sapmalar
- 2.1 Olumlu sapmalar
- 2.2 Olumsuz sapmalar
- 3 Örnekler
- 3.1 Temel karışım
- 3.2 Uçucu olmayan çözünen ikili karışım
- 4 Kaynakça
Nelerden oluşur??
Raoult kanunu, ilgili çözümlerin ideal bir şekilde davrandığı varsayımına dayanmaktadır: bunun nedeni, bu kanunun farklı moleküller arasındaki moleküller arası kuvvetlerin benzer moleküller arasındakilerle aynı olduğu fikrine dayanmasıdır (ki bu gerçekte çok başarılı değil).
Aslında, bir çözüm idealliğe ne kadar yakınsa, bu kanunun öngördüğü özelliklere uyması için o kadar fazla fırsat olacaktır..
Bu yasa, bir çözeltinin buhar basıncını uçucu olmayan bir çözünen maddeyle ilişkilendirir; bunun, bu sıcaklıktaki saf çözünen maddenin buhar basıncına eşit olacağını ve bunun molar fraksiyonu ile çarpıldığını belirtir. Bu, tek bir bileşen için matematiksel terimlerle şu şekilde ifade edilir:
Pben = Pºben . Xben
Bu ifadede Pben gaz karışımı içindeki P bileşeninin kısmi buhar basıncına eşittir, Pºben saf bileşenin i ve X’in buhar basıncı,ben Bileşen i'nin karışımdaki mol oranı.
Aynı şekilde, bir çözümde birkaç bileşeniniz varsa ve bir denge durumuna ulaştığında, Raoult yasasını Dalton ile birleştirerek çözümün toplam buhar basıncını hesaplayabilirsiniz:
P = PºbirXbir + PºBXB + PºCXc...
Ayrıca, sadece bir çözünen ve çözücünün mevcut olduğu çözeltilerde, kanun aşağıda gösterildiği şekilde formüle edilebilir:
Pbir = (1-XB) x Pºbir
Olumlu ve olumsuz sapmalar
Bu yasa ile çalışılabilecek çözümler normalde ideal olmalıdır, çünkü molekülleri arasındaki etkileşimler küçüktür ve istisnasız çözüm boyunca aynı özelliklerin üstlenilmesine izin verir..
Bununla birlikte, ideal çözümler gerçekte neredeyse yoktur, bu nedenle moleküller arası etkileşimleri temsil eden hesaplamalara iki katsayının dahil edilmesi gerekir. Bunlar kaçaklık katsayısı ve etkinlik katsayısıdır..
Bu anlamda, Raoult yasasına göre sapmalar, o dönemde elde edilen sonuçlara bağlı olarak, pozitif ya da negatif olarak tanımlanmaktadır..
Olumlu sapmalar
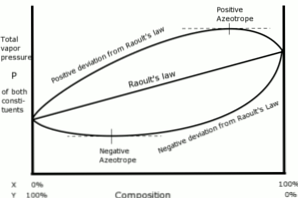
Raoult yasası ile ilgili pozitif sapmalar, çözümün buhar basıncı Raoult yasası ile hesaplanandan daha büyük olduğunda ortaya çıkar..
Bu, benzer moleküller arasındaki birleşme kuvvetleri, farklı moleküller arasındaki aynı kuvvetlerden daha büyük olduğunda meydana gelir. Bu durumda, her iki bileşen de daha kolay buharlaşır.
Bu sapma, buhar basıncı eğrisinde, belirli bir bileşimde maksimum bir nokta olarak görülür ve pozitif bir azeotrop oluşturur..
Azeotrop, sanki tek bir bileşen tarafından oluşturulmuş gibi davranan ve bileşimi değiştirmeden buharlaşan iki veya daha fazla kimyasal bileşiğin sıvı bir karışımıdır..
Olumsuz sapmalar
Raoult yasasından olumsuz sapmalar, karışımın buhar basıncı, yasa ile hesaplandıktan sonra beklenenden daha düşük olduğunda meydana gelir..
Bu sapmalar, karışımın molekülleri arasındaki uyum kuvvetleri, saf hallerinde sıvıların parçacıkları arasındaki kuvvetlerin ortalamasından daha büyük olduğunda ortaya çıkar..
Bu tür sapma, her bir bileşenin sıvı halde, maddenin saf halindeki maddeden daha büyük olan çekici kuvvetler tarafından tutulmasını sağlar, böylece sistemin kısmi buhar basıncı azalır..
Buhar basıncı eğrilerindeki negatif azeotroplar minimum bir noktayı temsil eder ve karışımda yer alan iki veya daha fazla bileşen arasında bir afinite gösterir.
Örnekler
Raoult kanunu, moleküller arası kuvvetlerine dayanan bir çözümün baskısını hesaplamak, hesaplanan değerleri herhangi bir sapma olup olmadığına ve bunun pozitif mi yoksa olumsuz mu olacağına karar vermek için gerçek değerlerle karşılaştırmak için kullanılır. Raoult yasasının kullanımına iki örnek:
Temel karışım
Propan ve bütandan oluşan aşağıdaki karışım, buhar basıncının yaklaşık bir değerini temsil eder ve her iki bileşenin, 40 ° C'lik bir sıcaklıkta, (50-50) içinde eşit oranlarda olduğunu varsayabiliriz:
Xpropan = 0.5
Pºpropan = 1352.1 kPa
Xbütan = 0.5
Pºbütan = 377.6 kPa
Raoult yasası ile hesaplanır:
Pkarışım = (0,5 x 377,6 kPa) + (0,5 x 1352,1 kPa)
Yani:
Pkarışım = 864.8 kPa
Uçucu olmayan çözünen ile ikili karışım
Bazen karışımın çözünmesi uçucu değildir, bu nedenle buhar basıncının davranışını anlamak için yasa kullanılır..
Normal sıcaklık koşullarında sırasıyla% 95 ve% 5 oranlarında su ve şeker karışımı verilir:
Xsu = 0.95
Pºsu = 2.34 kPa
Xşeker = 0.05
Pºşeker = 0 kPa
Raoult yasası ile hesaplanır:
Pkarışım = (0.95 x 2.34 kPa) + (0.05 x 0 kPa)
Yani:
Pkarışım = 2.22 kPa
Açıkça, moleküller arası kuvvetlerin etkisinden dolayı su buharı basıncında bir çökme meydana gelmiştir..
referanslar
- Anne Marie Helmenstine, P. (s.f.). Raoult Yasası Tanımı. Thoughtco.com sitesinden alındı
- ChemGuide. (N.D.). Raoult Kanunu ve Uçucu Olmayan Çözümler. Chemguide.co.uk sitesinden alındı.
- LibreTexts. (N.D.). Raoult Yasası ve İdeal Sıvı Karışımları. Chem.libretexts.org sitesinden alındı.
- Neutrium. (N.D.). Raoult Yasası. Neutrium.net sitesinden alındı
- Vikipedi. (N.D.). Raoult Yasası. En.wikipedia.org sitesinden alındı


