Kalsiyum Hidrit (CaH2) Özellikleri, Reaktivite ve Kullanımları
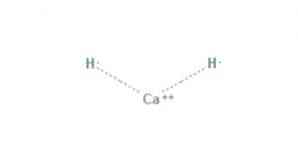
kalsiyum hidrit bir alkalin toprak hidrit yapan CaH2 formülüne sahip kimyasal bir bileşiktir. Bu kimyasal bileşik, Şekil 1'de gösterildiği gibi, kalsiyum ve iki hidrit iyonu arasındaki iki iyonik bağa sahiptir..
Tuzlu bir hidrür, yani yapısının tuza benzer olduğu anlamına gelir. Kristal yapısı, Şekil 2'de gösterilen kurşun klorürün (Cotunnite minerali) yapısıyla aynıdır..

Bütün alkalin ve alkalin toprak metalleri hidrit tuzları oluşturur. Kimyada bir hidrit, hidrojen anyonu, H- veya daha yaygın olarak, bir veya daha fazla hidrojen merkezinin nükleofilik, indirgeyici veya bazik özelliklere sahip olduğu bir bileşiktir.
Hidrit sayılan bileşiklerde, hidrojen atomu daha elektropozitif bir elemana veya gruba bağlanır..
Kalsiyum ve hidrojenin 300 ila 400 derece santigrat arasında bir sıcaklıkta reaksiyona sokulmasıyla üretilebilir. Kalsiyum hidrid hazırlamanın başka bir yolu kalsiyum klorürü hidrojen ve sodyum metal ile birlikte ısıtmaktır. Reaksiyon şu şekilde gerçekleşir:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Bu reaksiyonda kalsiyum (Ca) ve hidrojen (H) bir kalsiyum hidrit molekülü oluştururken, klor ile birlikte sodyum atomları sodyum klorür molekülleri (NaCl) oluşturur..
Kalsiyum hidrid ayrıca magnezyum (Mg) ile kalsiyum oksidi (CaO) azaltarak da üretilebilir. Reaksiyon, hidrojen varlığında gerçekleştirilir. Bu reaksiyon aynı zamanda magnezyum oksit (MgO) üretir. Aşağıda bu kimyasal reaksiyon için formül verilmiştir:
CaO + Mg + H2 → CaH2 + MgO
indeks
- 1 Kalsiyum hidrürün fiziksel ve kimyasal özellikleri
- 2 Tepkime ve tehlikeler
- 3 Taşıma ve depolama
- 4 Kullanımlar ve uygulamalar
- 4.1 Kurutucu madde
- 4.2 Hidrojen üretimi
- 4.3 İndirgeyici ajan
- 5 Kalsiyum hidrit kullanımının dezavantajı
- 6 Kaynakça
Kalsiyum hidrürün fiziksel ve kimyasal özellikleri
Kalsiyum hidrit, saf olduğunda beyaz ortofobik bir yapıya sahip bir kristaller kümesidir. Genellikle bu şekilde bulmak nadirdir, bu nedenle genellikle grimsi bir renk tonu vardır. Karakteristik bir kokusu yoksundur. Görünümü Şekil 3'te gösterilmiştir (Royal Society of Chemistry, 2015).

42,094 g / mol moleküler ağırlığa sahip, 816 santigrat derece erime noktasına ve 1.70 g / ml yoğunluğa sahiptir. Suda çözülürse şiddetli şekilde reaksiyona girerek hidrojen üretir. Aynı zamanda alkol ile reaksiyona girer (Ulusal Biyoteknoloji Bilgi Merkezi., S.F.).
Tepkime ve tehlikeler
Kalsiyum hidrid suya veya neme karşı oldukça reaktif olmasına rağmen kararlı bir kimyasaldır. Su ile temasında, kendiliğinden tutuşabilen yanıcı hidrojen gazları açığa çıkarır..
Patlayıcı bir bileşik olarak kabul edilir. Tetrahidrofuran ile bir reaksiyonda ısıtıldığında, patlamaya neden olabilir. Klorat, hipoklorit, bromat, potasyum perklorat ile karıştırıldığında ısıya, sürtünmeye ve patlayıcı hale gelir (Calcium Hydride 7789-78-8, 2016).
Gümüş florür kalsiyum hidrit ile ezildiğinde, kütle akkor hale gelir. Hidritin klor, brom veya iyot ile güçlü bir şekilde ısıtılması akkorluğa neden olur.
Hidrürün çeşitli bromatlarla, örneğin baryum bromat veya kloratlarla, örneğin baryum kloratla ve potasyum perklorat gibi perkloratlarla karışımları tritürasyon sırasında patlar. CaH2 sürtünmeye maruz kalırsa gümüş florür ile akkor reaksiyona girer.
Bu bileşik inert bir atmosferde kullanılmalıdır. Doğru şekilde kullanılmazsa, laboratuvar personelinin, cankurtaranların ve kimyasal atık işleyicilerin sağlık ve güvenliği için ciddi bir tehdit oluşturabilir (UC laboratuvar güvenliği merkezi, 2013).
Cilt veya gözlerle temas halinde tahriş edici olması nedeniyle son derece tehlikelidir. Cilt ile temasında çok tehlikelidir, çünkü aşındırıcı olabilir..
Yutulması ve solunması halinde de tehlikelidir. Doku hasarı miktarı temanın uzunluğuna bağlıdır. Gözlerle teması kornea hasarı veya körlüğe neden olabilir.
Cilt ile temasında iltihaplanma ve kabarcıklara neden olabilir. Tozun solunması, yanma, hapşırma ve öksürme ile karakterize gastrointestinal veya solunum yollarında tahrişe neden olur.
Aşırı maruz kalma, akciğerde hasara, boğulmaya, bilinç kaybına ve hatta ölüme neden olabilir. Göz iltihabı kızarıklık, tahriş ve kaşıntı ile karakterizedir. Derinin iltihabı kaşıntı, peeling, kızarıklık veya bazen de kabarma ile karakterizedir.
Gözlerin düşük seviyede tekrar tekrar maruz bırakılması göz tahrişine neden olabilir. Cilde tekrar tekrar maruz kalmak, yerel cilt tahribatına veya dermatite neden olabilir.
Tozun tekrar tekrar solunması, çeşitli derecelerde solunum tahrişine veya akciğerde hasara neden olabilir. Tekrar tekrar veya uzun süreli toz solunması kronik solunum tahrişine neden olabilir (Malzeme Güvenlik Bilgi Formu Kalsiyum hidrit MSDS, 2005).
Göz ile temasında derhal bol su ile en az 15 dakika bol su ile yıkanmalı, ara sıra üst ve alt göz kapakları kaldırılmalıdır.
Ciltle teması halinde, derhal bulaşmış giysileri ve ayakkabıları çıkarırken en az 15 dakika bol su ile yıkayınız..
Yutulduğunda, kusma tetiklenmemelidir. Bir zehir kontrol merkezi çağrılmalıdır. Sergi alanından ayrılıp derhal dışarıya çıkmanız tavsiye edilir..
Solunması halinde solunması zorsa, oksijen vermek gerekir. Mağdurun maddeyi yutması veya solması halinde ağızdan ağıza solunum yapılmamalıdır..
Yapay solunum, tek yönlü bir valf veya başka uygun bir solunum cihazı ile donatılmış bir cep maskesi yardımı ile başlatılmalıdır. Her durumda, derhal tıbbi yardım alınmalıdır..
Taşıma ve depolama
Bileşik kuru bir kapta sıcaktan uzak tutulmalıdır. Tutuşma kaynaklarından uzak tutulmalıdır. Tozlarını solumayın. Bu ürüne su eklenmemelidir
Yetersiz havalandırma durumunda, filtre maskesi gibi uygun solunum ekipmanı kullanın. Maruz kalma durumunda tıbbi yardım almalı ve etiketi mümkün olduğunca göstermelisiniz. Cilt ve gözlerle temasından kaçının.
Yanıcı maddeler, genel olarak, ayrı bir güvenlik kabini veya depoda saklanmalıdır. Kabı sıkıca kapalı tutun.
Serin ve iyi havalandırılan bir yerde saklayın. Elektrik kıvılcımlarını önlemek için malzeme içeren tüm ekipman topraklanmalıdır. Konteyner kuru ve serin bir yerde muhafaza edilmelidir.
Yanıcı olmayan bir malzemedir. Bununla birlikte, itfaiyeciler bu kimyasal bileşik etrafındaki yangını söndürürken uygun ekipman takmalıdırlar..
Kalsiyum hidrit etrafındaki yangını söndürmek için su kullanılması kesinlikle tavsiye edilmez. Kuru kum, bu amaçla sodyum klorür ve sodyum karbonat gibi bileşiklerin yanı sıra kullanılabilir.
Kalsiyum hidrit atıklarını uzaklaştırmak için, karıştırılırken bir azot atmosferi altında her bir hidrit gramı için 25 ml metanol eklenerek ayrıştırılmalıdır..
Reaksiyon bittiğinde, sulu sudaki kalsiyum metoksit bileşiğine aynı hacimde su eklenir ve bol su ile drenaja boşaltılır (National Research Council, 1995)..
Kullanımlar ve uygulamalar
Kurutucu ajan
Potasyum hidrit nispeten hafif bir kurutucudur. Bu nedenle, bu bileşiğin bir kurutucu madde olarak kullanımı, sodyum-potasyum ve sodyum metal alaşımları gibi daha reaktif maddelerle karşılaştırıldığında daha güvenlidir. Su ile aşağıdaki şekilde reaksiyona girer:
CaH2 + 2 H20 → Ca (OH) 2 + 2 H2
Bu reaksiyonun hidroliz ürünleri, hidrojen (gaz) ve Ca (OH) 2 (sulu bir karışım), bir süzme, damıtma veya temizleme işleminin ardından kimyasal çözücüden ayrılabilir..
Bu kimyasal bileşik, aminler ve piridin gibi birçok temel çözücü için etkili bir kurutucu maddedir. Bazen daha reaktif kurutucular kullanmadan önce çözücüleri önceden kurutmak için kullanılır.
Hidrojen üretimi
1940'larda bu bileşik, "Hydrolith" ticari ismi altında bir hidrojen kaynağı olarak mevcuttu..
Uzun süredir hidrojen kaynağı olarak kullanılmıştır. Laboratuvarlarda çeşitli deneyler, ileri yakıt hücreleri ve batarya uygulamaları için saf hidrojen üretmek için hala kullanılmaktadır. (American Elements, S.F.).
Bileşik, hava balonlarını şişirmek için güvenli ve uygun bir araç olarak yıllardır yaygın olarak kullanılmaktadır..
Aynı şekilde, laboratuvarlarda düzenli olarak küçük miktarlarda saf hidrojen hidrojen üretmek için kullanılır. Dizel yakıtın nem içeriği, CaH2 ile işlemden sonra geliştirilen hidrojen tarafından hesaplanır.
Azaltıcı ajan
600 ila 1000 derece arasında ısıtıldığında, bu metallerin tozunu hazırlamak için zirkonyum oksit, niyobyum, uranyum, krom, titanyum, vanadyum ve tantal azaltılabilir, böylece metalurjide kalsiyum hidrit kullanılabilir tozdan.
Aşağıdaki reaksiyon, kalsiyum hidridin bir indirgeyici madde olarak etki etme şeklini gösterir:
TiO + 2CaH2 → CaO + H2 + Ti
Kalsiyum hidrit kullanımının dezavantajı
Bu kimyasal bileşik genellikle bir kurutma maddesi olarak tercih edilen bir seçenektir; Ancak, bazı dezavantajları da vardır:
-Bu bileşiğin kuruma etkisi yavaştır, çünkü şiddetli bir şekilde reaksiyona girmediği hiçbir çözücü içinde çözünür değildir..
-Bu toz bileşik birçok çözücüyle uyumlu değildir. Klorokarbonlarla reaksiyonunuz patlamaya bile neden olabilir.
-Çözünmüş oksijeni gideremediğinden, deoksijenleyici solventler için kullanılamaz..
-Kalsiyum hidrit ve kalsiyum hidroksit arasında ayrım yapmak, benzer görünümleri nedeniyle oldukça zordur..
referanslar
- Amerikan Elemanları. (S.F.). kalsiyum hidrid. Americanelements.com adresinden alındı: americanelements.com.
- Kalsiyum Hidrit 7789-78-8. (2016). Chemicalbook.com adresinden alındı: chemicalbook.com.
- kalsiyum hidrid. (N.D.). Kimya öğrencisinden alındı: chemistrylearner.com.
- Malzeme Güvenlik Bilgi Formu Kalsiyum hidrit MSDS. (2005, 10 Ekim). Sciencelab.com adresinden alındı: sciencelab.com.
- Ulusal Biyoteknoloji Bilgi Merkezi. (S.F.). PubChem Bileşik Veritabanı; CID = 105052. Pubchem.ncbi.nlm.nih.gov adresinden alındı: pubchem.ncbi.nlm.nih.gov.
- ulusal araştırma konseyi. (1995). Laboratuarda Basiretli Uygulamalar: Kimyasalların Kullanımı ve Bertarafı. Washinton: Ulusal Akademik Basın.
- Kraliyet Kimya Derneği. (2015). kalsiyum hidrid ID 94784. chemspider.com sitesinden alındı: chemspider.com.
- Laboratuvar güvenliği için UC merkezi. (2013, 18 Ocak). standart çalışma prosedürü kalsiyum hidrid. Chemengr.ucsb.edu'dan alındı: chemengr.ucsb.edu.


