Etan yapısı, özellikleri, kullanım alanları ve riskleri
etan C formülünün basit bir hidrokarbonu2'H6 etilen sentezinde oldukça değerli ve çeşitlendirilmiş bir kullanıma sahip renksiz ve kokusuz bir gaz doğası ile. Ayrıca, Güneş Sistemi etrafındaki diğer gezegenlerde ve yıldız cisimlerinde de tespit edilen karasal gazlardan biridir. Bilim adamı Michael Faraday tarafından 1834 yılında keşfedildi..
karbon atomu ve (hidrokarbonlar olarak da bilinir), hidrojen ile meydana getirilen organik bileşiklerin büyük sayısının arasında, büyük ölçüde, çeşitli endüstrilerde kullanılan sıcaklık ve basınç, bir gaz halinde olanlar vardır.
Bunlar genellikle insanlık için değeri yüksek bir ürün olan "doğal gaz" olarak adlandırılan gaz karışımından gelir ve diğerleri arasında metan tipi metan, etan, propan ve bütan oluşturur; zincirindeki karbon atomu miktarına göre sınıflandırılmış.
indeks
- 1 Kimyasal yapı
- 1.1 Etan sentezi
- 2 Özellikler
- 2.1 Etanın çözünürlüğü
- 2.2 Etan kristalleşmesi
- 2.3 Etan yanması
- 2.4 Atmosferde ve gök cisimlerinde etan
- 3 Kullanım
- 3.1 Etilen üretimi
- 3.2 Temel kimyasalların eğitimi
- 3.3 Soğutucu akışkan
- 4 Etan riski
- 5 Kaynakça
Kimyasal yapısı
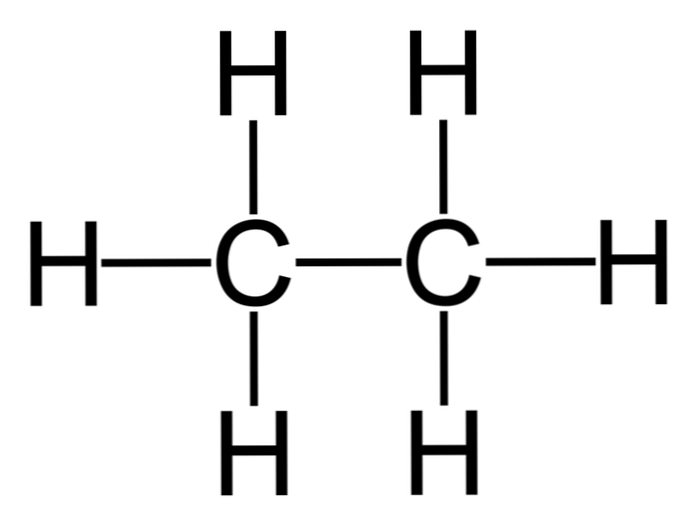
Etan, formül C'ye sahip bir moleküldür.2'H6, tipik olarak iki metil grubunun birliği olarak görülür (-CH3) basit bir karbon-karbon bağının hidrokarbonunu oluşturmak için. Aynı zamanda metandan sonra en basit organik bileşiktir ve aşağıdaki gibi temsil edilir:
'H3C-CH3
Bu moleküldeki karbon atomları sp hibridizasyonuna sahiptir3, Böylece moleküler bağlar serbest dönme sağlar.
Aynı zamanda, bunun moleküler yapının dönme ve bilim adamlarının "engel etan" adlı olan bağlantıyı 360 bir dönmesini meydana getirmek üzere gerekli olan minimum enerji dayanan bir etan içsel fenomen olduğu.
Bu sebeple etan, rojenlerine göre farklı konfigürasyonlarda ortaya çıkabilir, ancak hidrojenlerin birbirleriyle zıt olduğu daha kararlı bir yapıya sahip olmasına rağmen (şekilde gösterildiği gibi).

Etan sentezi
Etan kolayca Kolbe elektroliz, iki aşama meydana geldiği bir organik reaksiyonundan sentezlenebilir: Bir elektro-kimyasal dekarboksilasyon iki karboksilik asitlerin (karboksil grubu ve karbon dioksit salım çıkarılması) ve kombine ürünler kovalent bir bağ oluşturmak için ara maddeler.
Benzer şekilde, asetik asitin elektrolizi, etan ve karbon dioksit oluşumuna yol açar ve bu reaksiyon, ilk sentezlemek için kullanılır..
Asetik anhidridin Kolbe'nin elektrolizine benzer bir kavram olan peroksitlerin etkisiyle oksidasyonu da etan oluşumuna yol açar..
Aynı şekilde, bu gazı yakalamak ve diğer gazlarla karışımlarından ayırmak için kriyojenik sistemler kullanarak, bir sıvılaştırma işlemi ile doğal gaz ve metandan verimli bir şekilde ayrılabilir..
turbo-genleştirici işlem bu rol için tercih edilir: aynı bir genişleme üretilmesi, bir türbin gaz karışımının geçirilir, sıcaklık -100 ° C altına düşene kadar.
Bu noktada, karışımın bileşenleri ayırt edilebilir, böylece sıvı etan gazlı metandan ve bir damıtma kullanımıyla ilgili diğer türlerden ayrılır..
özellikleri
Etan, doğada standart basınç ve sıcaklıklarda (1 atm ve 25 ° C) kokusuz ve renksiz bir gaz olarak ortaya çıkar. -88.5 ºC kaynama noktasına ve -182.8 ºC erime noktasına sahiptir. Ayrıca, güçlü asitlere veya bazlara maruz kalmadan etkilenmez..
Etanol çözünürlük
Etan molekülleri simetrik yapıya sahiptir ve dağılma kuvvetleri olarak adlandırılan ve onları bir arada tutan çekici çekim kuvvetlerine sahiptir..
Etan suda çözülmeye çalışıldığında, gaz ve sıvı arasında oluşan çekim kuvvetleri çok zayıftır, böylece etanın su molekülleri ile birleşmesi çok zordur..
Bu nedenle, etanın çözünürlüğü oldukça düşüktür, sistem basıncı yükseldiğinde hafifçe artar.
Etan kristallenmesi
Etan katılaşabilir, bu da kübik bir kristal yapıya sahip kararsız etan kristallerinin oluşumu ile sonuçlanır..
-183.2 ° C'nin üzerindeki bir sıcaklık düşüşüyle bu yapı monoklinik hale gelir ve molekülün stabilitesini arttırır.
Etan yanması
Bu hidrokarbon, yaygın olarak yakıt olarak kullanılmamasına rağmen, yanma işlemlerinde, aşağıdaki şekilde gösterilen karbondioksit, su ve ısı üretmek için kullanılabilir:
2C2'H6 + 7o2 → 4CO2 + 6H2O + 3120 kJ
"Eksik yanma" olarak bilinen ve oksijen girişi olarak istenmeyen bir reaksiyonda amorf karbon ve karbon monoksit oluşumu ile sonuçlanan bir fazla oksijen olmadan bu molekülü yakmak mümkündür :
2C2'H6 + 3O2 → 4C + 6H2O + Isı
2C2'H6 + 4O2 → 2C + 2CO + 6H2O + Isı
2C2'H6 + 5O2 → 4CO + 6H2O + Isı
Bu alanda yanma, yüzlerce farklı reaksiyonda numaralandırılmış bir dizi serbest radikal reaksiyonu ile gerçekleşir. Örneğin, formaldehit, asetaldehit, metan, metanol ve etanol gibi bileşikler eksik yanma reaksiyonlarında oluşturulabilir..
Bu, reaksiyonun gerçekleştiği koşullara ve ilgili serbest radikal reaksiyonlara bağlı olacaktır. Etilen ayrıca, endüstri tarafından çok arzulanan bir ürün olan yüksek sıcaklıklarda (600-900 ºC) oluşabilir..
Atmosferdeki etan ve gök cisimleri
Etan, Dünya gezegeninin atmosferinde izlerde bulunur ve sınai faaliyetlerini uygulamaya başladığından bu yana insanın bu konsantrasyonu ikiye katladığından şüphelenilmektedir..
Etan küresel emisyon düzeldi şeyl gazı üretim teknolojileri beri neredeyse yarı yarıya azalmasına rağmen bilim adamları bir (atmosferdeki Etan şimdiki varlığının bu kadar sebebiyle fosil yakıtların yakılması inanıyorum doğal gaz kaynağı).
Bu tür aynı zamanda doğal olarak güneş ışınlarının bir etan molekülü yeniden birleştiren ve oluşturan atmosferik metan üzerindeki etkisiyle de üretilir..
Etan, Satürn'ün aylarından biri olan Titan'ın yüzeyinde sıvı halde bulunur. Bu, denizlerinden birine doğru 400 kilometreden fazla akan Vid Flumina Nehri'nde daha fazla miktarda meydana gelir. Bu bileşik ayrıca kuyruklu yıldızlar ve Pluto yüzeyinde de gösterilmiştir..
uygulamaları
Etilen üretimi
Etan kullanımı, esas olarak buharla parçalama olarak bilinen bir işlemle dünya üretiminde en yaygın kullanılan organik ürün olan etilen üretimine dayanmaktadır..
Bu işlem, buharla seyreltilmiş bir etan beslemesinin bir fırına geçirilmesini, hızlı bir şekilde oksijensiz ısıtılmasını içerir..
Reaksiyon çok yüksek bir sıcaklıkta (850 ila 900 ° C arasında) gerçekleşir, ancak reaksiyonun etkili olabilmesi için kalma süresinin (fırının içindeki etan tarafından harcanan süre) kısa olması gerekir. Yüksek sıcaklıklarda, daha fazla etilen üretilir.
Temel kimyasalların eğitimi
Etan ayrıca temel kimyasalların oluşumunda ana bir bileşen olarak incelenmiştir. Oksidatif klorlama, daha ucuz ve daha karmaşık olanların yerine vinil klorür (PVC'nin bir bileşeni) elde etmek için önerilen işlemlerden biridir..
soğutucu
Son olarak, etan, ortak kriyojenik sistemlerde bir soğutucu olarak kullanılır, ayrıca analiz için küçük numunelerin laboratuvarda dondurulabildiğini de gösterir..
Narin numunelerin soğutulması daha uzun süren ve aynı zamanda zararlı buz kristallerinin oluşumunu oluşturabilen su için çok iyi bir ikamedir..
Etan riskleri
-Etan, özellikle hava ile bağlandığında tutuşabilme özelliğine sahiptir. Havadaki% 3.0 ila% 12.5 etan oranlarında, patlayıcı bir karışım oluşabilir..
-Bulunduğu havadaki oksijeni sınırlayabilir ve bu nedenle mevcut ve maruz kalan insanlar ve hayvanlar için boğulma risk faktörü sunar..
-Dondurulmuş sıvı formdaki etan, cilde doğrudan temas ederse cildi ciddi şekilde yakabilir ve aynı zamanda birkaç dakika içerisinde donarak dokunduğu herhangi bir nesne için kriyojenik bir ortam görevi görür..
-Sıvı etanın buharları havadan ağırdır ve zeminde yoğunlaşmıştır, bu, bir zincir yanma reaksiyonu oluşturabilen bir tutuşma riski oluşturabilir..
-Etanın içilmesi mide bulantısına, kusmaya ve iç kanamaya neden olabilir. Teneffüs, boğulmaya ek olarak baş ağrısına, konfüzyona ve ruh hali dalgalanmalarına neden olur. Kalp durması nedeniyle ölüm yüksek pozlamalarda mümkündür.
-Metan ve karbondioksit ile birlikte, insan ısınmasının yarattığı küresel ısınmaya ve iklim değişikliğine katkıda bulunan bir sera gazını temsil eder. Neyse ki, metandan daha az bol ve dayanıklıdır ve bundan daha az radyasyon emer.
referanslar
- Britannica, E. (s.f.). Etan. Britannica.com sitesinden alındı
- Nes, G. V. (s.f.). Tek kristalli yapılar ve etan, etilen ve asetilen elektron yoğunluğu dağılımları. Rug.nl'den kurtarıldı
- Sites, G. (s.f.). Etan: Kaynaklar ve Evyeler. Sites.google.com adresinden alındı
- SoftSchools. (N.D.). Etan Formülü. Softschools.com adresinden kurtarıldı
- Vikipedi. (N.D.). Etan. En.wikipedia.org sitesinden alındı


