Kimyasal Aktivasyon Enerjisinden Ne Oluyor, Hesaplama
kimyasal aktivasyon enerjisi (kinetik çalışmalar açısından) kimyasal bir reaksiyon başlatmak için gereken en az enerji miktarını ifade eder. Kimyasal kinetikte çarpışma teorisine göre, hareket halindeki tüm moleküllerin belirli bir miktarda kinetik enerjiye sahip olduğu söyleniyor..
Bu, hareketinizin hızı arttıkça kinetik enerjinizin büyüklüğü anlamına gelir. Bu anlamda, hızlı bir hareket taşıyan bir molekül kendi başına parçalara bölünemez, bu nedenle kimyasal bir reaksiyonun ortaya çıkması için kendisiyle başka bir molekül arasında bir çarpışma meydana gelmelidir..
Bu olduğunda - moleküller arasında bir çarpışma meydana geldiğinde - kinetik enerjisinin bir kısmı titreşimli enerjiye dönüşür. Benzer şekilde, eğer işlemin başında kinetik enerji yüksekse, çarpışmaya katılan moleküller mevcut kimyasal bağların bir kısmı kırılacak kadar büyük bir titreşim sunacaktır..
Bu bağların kopması, tepkenlerin ürünlere dönüşümünde ilk adımdır; bu, bunların oluşumunda. Öte yandan, eğer bu işlemin başında kinetik enerji küçük büyüklükte ise, içinde neredeyse tamamen ayrılacakları moleküllerin "geri tepme" olgusu olacaktır..
indeks
- 1 Ne içerir??
- 1.1 Aktif kompleks
- 2 Nasıl hesaplanır??
- 2.1 Bir kimyasal reaksiyonun aktivasyon enerjisinin hesaplanması
- 3 Aktivasyon enerjisi bir reaksiyonun hızını nasıl etkiler??
- 4 Aktivasyon enerjisi hesaplama örnekleri
- 5 Kaynakça
Nelerden oluşur??
Daha önce tarif edilen kimyasal reaksiyonları başlatmak için moleküller arasındaki çarpışma kavramından yola çıkarak, bir çarpışmanın gerçekleşmesi için gereken minimum enerjinin olduğu söylenebilir..
Bu yüzden, eğer enerji değeri bu minimumdan daha düşükse, çarpışma gerçekleştikten sonra moleküller arasında hiçbir değişiklik olmaz, bu demektir ki bu enerji yok olduğunda, söz konusu türler neredeyse bozulmadan kalır ve gerçekleşmez. Bu şok nedeniyle herhangi bir değişiklik.
Bu fikir sırasına göre, moleküller arasındaki çarpışmadan sonra bir değişimin gerçekleşmesi için gereken minimum enerjiye aktivasyon enerjisi denir..
Başka bir deyişle, bir şokta yer alan moleküllerin, aktivasyon enerjisine eşit veya bu değerden daha büyük bir miktarda toplam kinetik enerjiye sahip olmaları gerekir, böylece kimyasal bir reaksiyon oluşabilir..
Ayrıca, birçok durumda moleküller, "geçici hal" olarak da adlandırılan, aktive edilmiş kompleks denilen yeni bir türün çarpışması ve orijinli olması nedeniyle yalnızca geçici olarak var olur..
Çarpışma nedeniyle ve reaksiyon ürünlerinin oluşumundan önce reaksiyona giren türlerden kaynaklanır..
Aktif karmaşık
Yukarıda sözü edilen aktif madde kompleksi, çok düşük stabiliteye sahip olan ancak sırayla büyük miktarda potansiyel enerjiye sahip olan bir tür oluşturur..
Aşağıdaki diyagram, reaktiflerin ürünlere dönüşümünü enerji cinsinden ifade etmekte ve oluşan aktive edilmiş kompleksin enerjisinin büyüklüğünün reaktantların ve ürünlerinkinden önemli ölçüde daha büyük olduğuna dikkat çekmektedir..
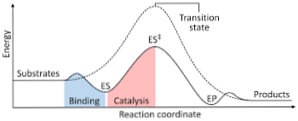
Reaksiyonun sonunda ürünler, reaksiyona giren maddelere göre daha fazla stabiliteye sahiplerse, enerji salınımı ısı şeklinde gerçekleşir ve ekzotermik bir reaksiyon verir..
Aksine, eğer tepkenler ürünlerden daha fazla büyüklükte bir stabilite ile sonuçlanırsa, bu, tepkime karışımının çevresinden ısı şeklinde bir enerji emilimini gösterdiği ve endotermik bir tepkimeyle sonuçlandığı anlamına gelir..
Benzer şekilde, eğer bir durum veya diğeri meydana gelirse, reaksiyonun ilerlemesine veya ilerlemesine karşı reaksiyona giren sistemin potansiyel enerjisinin çizildiği, daha önce gösterilenler gibi bir şema oluşturulmalıdır..
Bu şekilde, reaksiyon ilerledikçe meydana gelen potansiyel enerji değişimleri elde edilir ve reaktifler ürünlere dönüştürülür..
Nasıl hesaplanır?
Kimyasal bir reaksiyonun aktivasyon enerjisi, bu reaksiyonun hız sabitiyle yakından ilgilidir ve bu sabitin sıcaklığa bağımlılığı, Arrhenius denklemi ile temsil edilir:
k = Ae-Ea / RT
Bu ifadede k reaksiyonun hız sabitini (sıcaklığa bağlı olarak) ve parametreyi gösterir bir Frekans faktörü olarak adlandırılır ve moleküller arası çarpışmaların sıklığının bir ölçüsüdür..
Onun parçası için, ve Doğal logaritma serisinin temelini ifade eder. Aktivasyon enerjisinin negatif oranına eşit bir güce yükseltilir (ea) gaz sabitinden çıkan ürün arasında (R,) ve mutlak sıcaklık (Tdikkate alınacak sistemin).
Frekans faktörünün, geniş bir sıcaklık aralığında belirli reaksiyon sistemlerinde sabit olarak kabul edilebileceği belirtilmelidir..
Bu matematiksel ifadenin ilk olarak 1884'te Hollanda kökenli Jacobus Henricus van Hoff'in eczanesi tarafından varsayıldığı, ancak bilimsel geçerliliği olan ve öncülünü yorumlayan 1889 yılında İsveç doğumlu kimyacı Svante Arrhenius olduğu varsayılmıştır..
Kimyasal bir reaksiyonun aktivasyon enerjisinin hesaplanması
Arrhenius denklemi, bir reaksiyonun hız sabiti ile moleküller arasındaki çarpışmaların sıklığı arasında var olan doğrudan orantılılığa işaret eder..
Ayrıca, bu denklem, doğal logaritmaların özelliğini, denklemin her bir tarafına uygulayarak daha uygun bir şekilde gösterilebilir:
ln = ln A - Ea / RT
Bir çizginin denklemini elde etmek için terimleri yeniden sıralarken (y = mx + b), aşağıdaki ifade elde edilir:
k = (- Ea / R) (İ / T) + A
Bu nedenle, 1 / T'ye karşı bir ln k grafiği çizilirken, ln k'nin y koordinatını temsil ettiği bir düz çizgi elde ederiz, (- A / R), (m), (1 / T) çizgisinin eğimini temsil eder. x koordinatını temsil eder ve ln, koordinatların ekseni (b) ile kesişimi temsil eder..
Görülebileceği gibi, bu hesaplamadan kaynaklanan eğim, -Ea / R değerine eşittir. Bu, eğer aktivasyon enerjisinin değerini bu ifade ile elde etmek isteniyorsa, aşağıdakileri sağlayacak şekilde basit bir temizleme yapılması gerektiği anlamına gelir:
Ea = -mR
Burada m ve R'nin 8.314 J / K · mol'e eşit bir sabit olduğunu biliyoruz..
Aktivasyon enerjisi bir reaksiyonun hızını nasıl etkiler??
Aktivasyon enerjisinin bir görüntüsünü oluşturmaya çalışırken, düşük enerji molekülleri arasında bir reaksiyon oluşmasına izin vermeyen bir bariyer olarak kabul edilebilir..
Yaygın bir reaksiyonda olduğu gibi, reaksiyona girebilen moleküllerin sayısının oldukça fazla olduğu, bu moleküllerin kinetik enerjisinin hızı - ve eşdeğerde - çok değişken olabileceği gibi.
Genellikle, çarpışma yaşayan moleküllerin toplamının sadece küçük bir miktarının - daha yüksek hareket hızına sahip olanlar - aktivasyon enerjisinin büyüklüğünün üstesinden gelebilecek kadar kinetik enerji sunması olur. Böylece, bu moleküller reaksiyonun bir parçası olabilir ve uygun olurlar..
Arrhenius denklemine göre, aktivasyon enerjisi ile gaz sabiti çarpımı arasında mutlak sıcaklık ile olan bölümden önce gelen negatif işaret, aktivasyon enerjisinde bir artış olduğu için hız sabitinin azaldığı anlamına gelir; sıcaklık arttığında bir büyümenin yanı sıra.
Aktivasyon enerjisi hesaplama örnekleri
Arrhenius denklemine göre bir grafik oluşturarak aktivasyon enerjisini hesaplamak için, asetaldehitin ayrışma reaksiyonu için hız sabitlerinin beş farklı sıcaklıkta ölçüldüğünü ve aktivasyon enerjisini belirlemek istedik aşağıdaki gibi ifade edilen reaksiyon için:
CH3CHO (g) → CH4(g) + CO (g)
Beş ölçümün verileri aşağıdaki gibidir:
k (1 / M1/2· S): 0,011-0,035-0,105-0,343-0,789
T (K): 700 - 730 - 760 - 790 - 810
Öncelikle, bu bilinmeyeni çözmek ve aktivasyon enerjisini belirlemek için düz bir çizgi elde etmek ve buradan eğimi almak ve Ea değerini bulmak için ln k - 1 / T (y - x) bir grafik yapmalıyız. açıklandığı gibi.
Arrhenius denklemine [ln k = (- Ea / R) (1 / T) + ln A] göre ölçüm verilerinin dönüştürülmesi sırasıyla y ve x için bulunur:
kn: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Bu değerlerden ve eğimin matematiksel olarak hesaplanması yoluyla - bir bilgisayarda veya hesap makinesinde, m = (Y ifadesiyle)2-ve1) / (X2-X1) veya doğrusal regresyon yöntemini kullanarak- m = -Ea / R = -2.09 * 10 elde edersiniz4 K. Yani:
Ea = (8.314 J / K · mol) (2.09 * 104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
Diğer aktivasyon enerjilerini grafiksel olarak belirlemek için, benzer bir prosedür gerçekleştirilir..
referanslar
- Vikipedi. (N.D.). Aktivasyon Enerjisi. En.wikipedia.org sitesinden alındı
- Chang, R. (2007). Kimya, Dokuzuncu baskı. Meksika: McGraw-Hill.
- Britannica, E. (s.f.). Aktivasyon enerjisi Britannica.com sitesinden alındı
- Moore, J.W. ve Pearson, R.G. (1961). Kinetik ve Mekanizması. Books.google.co.ve adresinden alındı
- Kaesche, H. (2003). Metallerin Korozyonu: Fizikokimyasal Prensipler ve Güncel Sorunlar. Books.google.co.ve adresinden alındı


