Kalorimetre tarihi, parçaları, çeşitleri ve özellikleri
kalorimetre bilinen spesifik ısıdaki bir madde miktarının (genellikle su) sıcaklığındaki değişimi ölçmek için kullanılan bir cihazdır. Sıcaklıktaki bu değişim, incelenen işlemde emilen ya da bırakılan ısı nedeniyledir; bir reaksiyon ise kimyasal veya faz veya durum değişikliğinden oluşuyorsa fiziksel.
Laboratuvarda, bulunabilecek en basit kalorimetre kahve fincanınınkidir. Bir reaksiyonda emilen veya bırakılan ısının sabit basınçta sulu çözeltide ölçülmesinde kullanılır. Reaksiyonlar, reaktiflerin veya gaz ürünlerin müdahalesini önlemek için seçilir.
 Ekzotermik bir reaksiyonda, salınan ısı miktarı, kalorimetre ve sulu çözeltinin sıcaklığındaki artıştan hesaplanabilir:
Ekzotermik bir reaksiyonda, salınan ısı miktarı, kalorimetre ve sulu çözeltinin sıcaklığındaki artıştan hesaplanabilir:
Reaksiyonda salınan ısı miktarı = kalorimetre tarafından absorbe edilen ısı miktarı + çözelti tarafından absorbe edilen ısı miktarı
Kalorimetre tarafından emilen ısı miktarına kalorimetrenin kalori kapasitesi denir. Bu, kalorimetreye belli bir miktarda su ile bilinen miktarda ısı sağlanmasıyla belirlenir. Daha sonra, kalorimetrenin sıcaklık artışı ve içerdiği çözelti ölçülür..
Bu veriler ve suyun özgül ısısının kullanılmasıyla (4.18 J / g.ºC), kalorimetrenin kalorik kapasitesi hesaplanabilir. Bu kapasiteye kalorimetre sabiti de denir..
Öte yandan, sulu çözelti tarafından kazanılan ısı, eşdeğerine eşittir. M = su kütlesi formülünde, ce = suyun özel ısısı ve Δt = sıcaklık değişimi. Bütün bunları bilerek, ekzotermik reaksiyon tarafından salınan ısı miktarı hesaplanabilir..
indeks
- 1 Kalorimetrenin Tarihçesi
- 2 Parça
- 3 Çeşitleri ve özellikleri
- 3.1 Kahve Fincanı
- 3.2 Kalorimetrik pompa
- 3.3 Adyabatik kalorimetre
- 3.4 İzoperibolik kalorimetre
- 3.5 Akış kalorimetresi
- 3.6 Diferansiyel taramalı kalorimetre için kalorimetre
- 4 uygulama
- 4.1 Fizikokimyada
- 4.2 Biyolojik sistemlerde
- 4.3 Oksijen pompası ve kalorik güç kalorimetresi
- 5 Kaynakça
Kalorimetrenin tarihi
1780 yılında, Fransız kimyager A. L. Lavoisier, kimyanın babalarından biri olarak kabul edildi, ısı üretimini soluması ile ölçmek için bir kobay kullandı..
Nasıl? Kalorimetreye benzer bir cihaz kullanmak. Gine domuzu tarafından üretilen ısı, cihazı çevreleyen karın erimesiyle kanıtlandı..
Araştırmacılar A. L Lavoisier (1743-1794) ve P. S. Laplace (1749-1827), bir vücudun özgül ısısını buz eritme yöntemiyle ölçmek için kullanılan bir kalorimetre tasarladı..
Kalorimetre, vernikli, sehpa ile tutturulmuş ve dahili olarak bir huni ile sonlandırılmış, kalay kaplı silindirik bir beherden oluşuyordu. İçine, bir öncekine benzer şekilde, dış odadan geçen ve bir anahtar bulunan bir tüp ile başka bir cam yerleştirildi. İkinci camın içinde bir ızgara vardı.
Bu ızgaraya, özgül ısısını belirlemek isteyen varlık veya nesne yerleştirildi. Konsantrik damarların içine, tıpkı sepetteki gibi, buz yerleştirildi..
Vücut tarafından üretilen ısı, buz tarafından emilerek kaynaşmasına neden oldu. Ve buzun erimesinin sıvı su ürünü toplandı ve iç camın anahtarı açıldı..
Ve son olarak, suyu tartıp, erimiş buz kütlesini biliniyordu.
parçalar
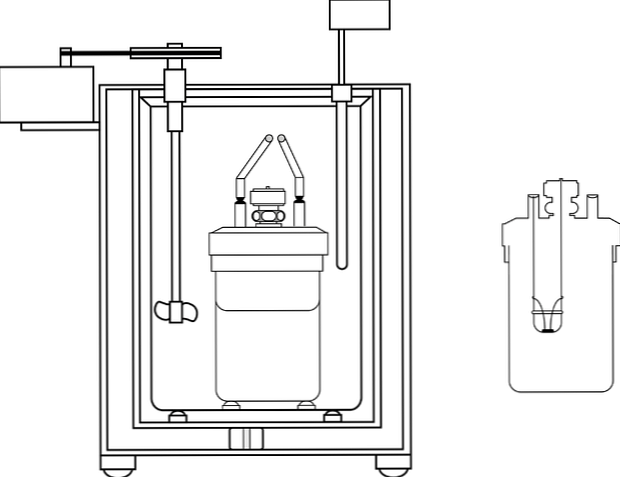
Kimya öğretimi laboratuarlarında en yaygın kullanılan kalorimetre, kahve fincanı kalorimetresidir. Bu kalorimetre bir beherden veya bunun yerine, belirli yalıtım özelliklerine sahip bir anime malzemesi kabından oluşur. Bu kabın içine sulu çözelti ısı üretecek veya soğuracak gövdeye yerleştirilir.
Kabın üst kısmına, iki delikli bir yalıtım malzemesi kapağı yerleştirilmiştir. Birinde sıcaklık değişimlerini ölçmek için bir termometre, diğerinde ise sulu çözeltinin içeriğini hareket ettirme işlevini yerine getiren tercihen cam malzemeden bir karıştırıcı yerleştirilir..
Resim, bir kalorimetrik pompanın parçalarını göstermektedir; Bununla birlikte, termometreye ve karıştırıcıya, birkaç kalorimetrede ortak elementlere sahip olduğu görülebilir..
Çeşitleri ve özellikleri
Kahve fincanı
Ekzotermik bir reaksiyonla salınan ısının ve endotermik bir reaksiyonda emilen ısının belirlenmesinde kullanılandır..
Ek olarak, bir vücudun özgül ısısının belirlenmesinde kullanılabilir; yani, maddenin bir gramının sıcaklığını bir dereceye kadar yükseltmek için absorbe etmesi gereken ısı miktarı. .
Kalorimetrik pompa
Sabit hacimde meydana gelen bir reaksiyonda serbest bırakılan veya emilen ısı miktarının ölçüldüğü bir cihazdır..
Reaksiyon, büyük miktarda suya batırılmış güçlü bir çelik kapta (pompa) gerçekleştirilir. Bu, su sıcaklığındaki değişiklikleri küçük yapar. Bu nedenle, reaksiyonla ilişkili değişikliklerin sabit sıcaklık ve hacimde ölçüldüğü varsayılmaktadır..
Yukarıdakiler, bir kalorimetrik pompada bir reaksiyon gerçekleştirildiğinde hiçbir işlem yapılmadığını gösterir..
Reaksiyon, pompaya bağlı kablolar yoluyla elektrik sağlanarak başlar.
Adyabatik kalorimetre
Kalkan denilen yalıtıcı bir yapıya sahip olması ile karakterize edilir. Kalkan, ısı ve sıcaklık değişimlerinin meydana geldiği hücre çevresinde bulunur. Ayrıca, ısı transferini önlemek için sıcaklığını hücreninkine çok yakın tutan bir elektronik sisteme bağlanır..
Adyabatik bir kalorimetrede, kalorimetre ve çevresi arasındaki sıcaklık farkı en aza indirilir; ısı transfer katsayısını ve ısı değişim zamanını minimize etmek.
Parçaları aşağıdakilerden oluşur:
-Isı kaybını önlemeye çalıştığı bir yalıtım sistemine entegre edilmiş hücre (veya kap).
-Sıcaklık değişimlerini ölçmek için termometre.
-Kontrol edilebilir bir elektrik voltajı kaynağına bağlı bir ısıtıcı.
-Ve daha önce bahsettiğim kalkan.
Bu kalorimetre türünde, entropi, Debye sıcaklığı ve elektronik hal yoğunluğu gibi özellikler belirlenebilir..
İzoperibolik kalorimetre
Reaksiyon hücresinin ve pompanın ceket denilen bir yapıya batırıldığı bir cihazdır. Bu durumda, ceket denilen sabit bir sıcaklıkta tutulan sudan oluşur..
Yanma işlemi sırasında ısı salınırken hücrenin sıcaklığı ve pompanın sıcaklığı artar; ancak su ceketinin sıcaklığı sabit bir sıcaklıkta tutulur.
Bir mikroişlemci, hücre ve ceketin sıcaklığını kontrol eder ve iki sıcaklık arasındaki farklardan kaynaklanan sızıntı ısısının gerekli düzeltmelerini yapar..
Bu düzeltmeler test öncesi ve sonrasında yapılan ölçümlere dayanarak sürekli ve son bir düzeltme ile uygulanır..
Akış kalorimetresi
Caliendar tarafından geliştirilen, konteynırdaki bir gazı sabit bir hızda hareket ettirecek bir cihaza sahiptir. Isı eklerken, akışkandaki sıcaklıktaki artış ölçülür.
Akış kalorimetresi aşağıdakilerle karakterize edilir:
- Sabit akış oranının kesin ölçümü.
- Bir ısıtıcıdan sıvıya verilen ısı miktarının doğru ölçümü.
- Enerji girişinden kaynaklanan gazdaki sıcaklık artışının doğru bir şekilde ölçülmesi
- Basınç altındaki gazın kapasitesini ölçmek için bir tasarım.
Diferansiyel taramalı kalorimetre için kalorimetre
İki kabı olması ile karakterize edilir: bir tanesinde incelenecek olan numune yerleştirilirken, diğeri boş tutulur veya bir referans materyali kullanılır.
İki gemi, iki bağımsız ısıtıcı aracılığıyla sabit bir enerji hızında ısıtılır. İki kabın ısıtılması başladığında, bilgisayar ısıtıcıların ısı akışının sıcaklığa karşı farkını grafik olarak gösterecek, böylece ısı akışını belirleyebilecek.
Ek olarak, zamanın bir fonksiyonu olarak sıcaklığın değişmesi belirlenebilir; ve son olarak, kalori kapasitesi.
uygulamaları
Fizikokimyada
-Bazik kalorimetreler, kahve fincanı, bir vücudun serbest bıraktığı veya emdiği ısı miktarını ölçmeye izin verir. Bir reaksiyonun ekzotermik mi endotermik mi olduğunu belirleyebilirler. Ek olarak, bir vücudun özgül ısısı belirlenebilir.
-Adyabatik kalorimetre ile kimyasal bir sürecin entropisini ve devletin elektronik yoğunluğunu belirlemek mümkün olmuştur.
Biyolojik sistemlerde
-Mikro kalorimetreler, moleküller arasındaki etkileşimleri ve ayrıca oluşan moleküler konformasyonel değişiklikleri içeren biyolojik sistemleri incelemek için kullanılır; örneğin, bir molekülün açılmasında. Çizgi, hem diferansiyel taramayı hem de izotermal titrasyonu içerir..
-Mikrokalorimetre küçük moleküllü ilaçların, biyoterapötiklerin ve aşıların geliştirilmesinde kullanılır..
Oksijen pompası kalorimetresi ve kalorik güç
Çok sayıda maddenin yanması, oksijen pompası kalorimetresinde gerçekleşir ve kalorik gücü belirlenebilir. Bu kalorimetrenin kullanımıyla incelenen maddeler arasında şunlar bulunmaktadır: kömür ve kok; ağır ve hafif hem yenilebilir yağlar; benzin ve tüm motor yakıtları.
Uçak reaktörleri için yakıt türlerinin yanı sıra; yakıt atıkları ve atık bertarafı; insan beslenmesi için gıda ürünleri ve takviyeleri; hayvan yemi için yem bitkileri ve takviyeleri; yapı malzemeleri; roket ve yakıt yakıtları.
Aynı şekilde, kalori gücü yanıcı maddelerin termodinamik çalışmalarında kalorimetri ile belirlendi; ekolojide enerji dengesi çalışmasında; Patlayıcı ve termal tozlarda ve temel termodinamik yöntemlerin öğretilmesinde.
referanslar
- Whitten, Davis, Peck ve Stanley. Kimya. (8. basım). CENGAGE Öğrenme.
- González J., Cortés L. ve Sánchez A. (s.f.). Adyabatik kalorimetri ve uygulamaları. Şu kaynaktan kurtarıldı: cenam.mx
- Vikipedi. (2018). Kalorimetre. Alınan: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 Haziran 2018). Kimyada Kalorimetre Tanımı. Alınan adres: thoughtco.com
- Gillespie, Claire. (11 Nisan 2018). Kalorimetre Nasıl Çalışır? Sciencing. Şu kaynaktan alındı: sciencing.com


