Kimyasal Denklemlerin Dengelenmesi Yöntem ve Örnekler
Kimyasal denklemlerin dengelenmesi Denklemde bulunan tüm elementlerin her iki tarafta aynı sayıda atom bulunduğunu belirtir. Bunu başarmak için, reaksiyonda bulunan her tür için uygun stokiyometrik katsayıları atamak için dengeleme yöntemlerini kullanmak gerekir..
Kimyasal bir denklem, iki veya daha fazla madde arasındaki kimyasal reaksiyon sırasında olanların sembollerle gösterimidir. Tepkenler birbirleriyle etkileşime girerler ve tepkime koşullarına bağlı olarak, bir veya daha fazla farklı bileşik ürün olarak elde edilir..
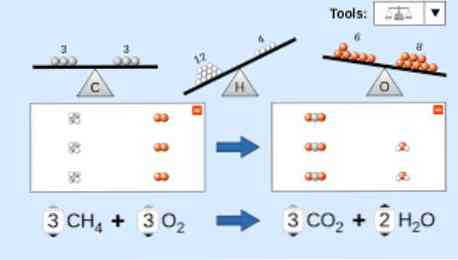
Bir kimyasal denklemi tanımlarken, aşağıdakiler dikkate alınmalıdır: İlk önce, tepkimeye giren maddeler denklemin sol tarafına yazılır, ardından gerçekleştirilen reaksiyonun türüne bağlı olarak tek yönlü bir ok veya iki zıt yatay ok bulunur. pelerin.
indeks
- 1 Kimyasal denklemleri dengeleme yöntemleri
- 1.1 Deneme ve yanılma ile kimyasal denklemler dengesi (ayrıca inceleme veya deneme olarak da adlandırılır)
- 1.2 Kimyasal denklemlerin cebirsel dengesi
- 1.3 Redoks denklemlerinin yuvarlanması (iyon elektron yöntemi)
- 2 Dengeleyici kimyasal denklem örnekleri
- 2.1 İlk örnek
- 2.2 İkinci örnek
- 2.3 Üçüncü örnek
- 3 Kaynakça
Kimyasal denklemlerin dengeleme yöntemleri
Tepkenlerin ve ürünlerin bilinmesi ve formüllerinin kendilerine karşılık gelen tarafta doğru bir şekilde ifade edilmesi temel alınarak, denklemleri aşağıdaki yöntemlere göre dengelemeye devam ediyoruz..
Kimyasal denklemlerin deneme yanılma ile dengelenmesi (ayrıca inceleme veya deneme olarak da adlandırılır)
Reaksiyonun stokiyometrisine dayanır ve denklemin dengelenmesi için farklı katsayılarla denemeye çalışır, mümkün olan en küçük tam sayıların her iki tarafta da aynı sayıda atomun elde edildiği seçildiği sürece reaksiyonun.
Bir tepken ya da ürünün katsayısı, formülünden önce gelen sayıdır ve bir denklemin dengelenmesi sırasında değiştirilebilecek tek sayıdır, çünkü formüllerin aboneliklerini değiştirmek, bileşiğin kimliğini değiştirecektir. söz konusu.
Say ve karşılaştır
Reaksiyonun her bir elementini belirledikten ve doğru tarafa yerleştirdikten sonra, denklemde mevcut olan her bir elementin atom sayısını saymaya ve karşılaştırmaya ve dengelenmesi gerekenleri belirlemeye devam ediyoruz.
Daha sonra, her bir elemanın dengelenmesiyle (birer birer), dengesiz elemanlar içeren her bir formülün önündeki tam katsayıları yerleştirerek devam ediyoruz. Genellikle metalik elementler önce dengelenir, sonra metalik olmayan elementler ve son olarak oksijen ve hidrojen atomları.
Bu şekilde, her bir katsayı önceki formülün tüm atomlarını çoğaltır; yani bir elementin dengelenmesi sırasında diğerleri dengesizlik yapabilir, ancak bu reaksiyon dengelendikçe düzeltilir.
Son olarak, tüm denklemin doğru bir şekilde dengelenmesi, yani maddenin korunma kanununa uyması son bir sayıyla desteklenir..
Kimyasal denklemlerin cebirsel dengesi
Bu yöntemi kullanmak için, kimyasal denklemlerin katsayılarını, çözülmesi gereken sistemin bilinmeyenleri olarak ele almak için bir prosedür belirlenir..
İlk olarak, reaksiyonun spesifik bir elemanı referans olarak alınır ve katsayılar, her bir moleküldeki o elementin mevcut atomlarına göre bilinmeyenleri temsil eden harfler (a, b, c, d ...) olarak yerleştirilir. bir tür içermeyen bir tür "0" yerleştirilir).
Bu birinci denklemi elde ettikten sonra, reaksiyonda bulunan diğer elementlerin denklemleri belirlenir; Söz konusu reaksiyondaki elementler kadar çok denklem olacaktır..
Son olarak bilinmeyenler, cebirsel indirgeme, eşitleme veya ikame metotlarından biri ile belirlenir ve doğru dengelenmiş denklemle sonuçlanan katsayılar elde edilir..
Dengeleme redoks denklemleri (iyon elektron yöntemi)
İlk olarak, genel (dengesiz) reaksiyon iyonik formunda yerleştirilir. Daha sonra bu denklem iki yarı-reaksiyona bölünür; oksidasyon ve indirgenme, her biri atom sayısına, türüne ve bunların yüklerine göre dengeleme.
Örneğin, asit ortamında meydana gelen reaksiyonlar için H molekülleri eklenir.2Veya oksijen atomlarını dengelemek ve H eklemek+ hidrojen atomlarını dengelemek.
Buna karşılık, bir alkalin ortamda eşit miktarda OH iyonu eklenir- Her H iyonu için denklemin iki tarafında+, ve H iyonlarının ortaya çıktığı yer+ ve OH- H molekülleri oluşturmak için bir araya geliyorlar2Ey.
Elektron ekle
Öyleyse, her bir yarım reaksiyondaki maddeyi dengelendikten sonra yükleri dengelemek için gerektiği kadar elektron eklemelisiniz..
Her yarım reaksiyonun yuvarlanmasından sonra, bunlar eklenir ve son denklemin deneme yanılma ile dengelenmesi ile sonuçlanır. İki yarı reaksiyonun elektronlarının sayısında bir fark olması durumunda, biri veya her ikisi de bu sayıya eşit bir katsayı ile çarpılmalıdır..
Son olarak, denklemin, küresel denklemin her iki tarafında aynı yüklere sahip olmasının yanı sıra aynı sayıda atom ve aynı atom tipini içerdiği doğrulanmalıdır..
Dengeleyici kimyasal denklem örnekleri
İlk örnek
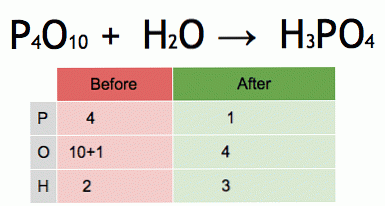
Bu dengeli bir kimyasal denklemin bir animasyonu. Fosfor pentoksit ve su fosforik aside dönüştürülür.
P4O10 + 6 H20 → 4 H3P04 (-177 kJ).
İkinci örnek
Etanın yanma reaksiyonuna sahipsiniz (dengesiz).
C2'H6 + Ey2 → CO2 + 'H2Ey
Dengeleme için deneme yöntemi ve hata kullanılarak, elementlerin hiçbirinin denklemin her iki tarafında aynı sayıda atom bulunmadığı görülmüştür. Böylece, karbon dengesi ile başlar, ürün tarafına eşlik eden stokiyometrik bir katsayı olarak iki tane ekler..
C2'H6 + Ey2 → 2CO2 + 'H2Ey
Karbon her iki tarafta da dengelenmiştir, bu yüzden su molekülüne üç ekleyerek hidrojeni dengelemeye devam ediyoruz.
C2'H6 + Ey2 → 2CO2 + 3H2Ey
Son olarak, denklemin sağ tarafında yedi oksijen atomu bulunduğundan ve hala dengelenmesi gereken son element olduğundan, 7/2 fraksiyonel sayı oksijen molekülünün önüne yerleştirilir (tüm katsayılar genel olarak tercih edilse de).
C2'H6 + 7 / 2O2 → 2CO2 + 3H2Ey
Sonra denklemin her iki tarafında aynı sayıda karbon atomu (2), hidrojen (6) ve oksijen (7) olduğunu doğrulayın..
Üçüncü örnek
Demirin dikromat iyonlarıyla oksidasyonu bir asit ortamında (dengesiz ve iyonik formunda) meydana gelir..
inanç2+ + Cr2Ey72- → İnanç3+ + Cr3+
İyon-elektron yöntemini dengelemesi için kullanarak iki yarı reaksiyona bölünür.
Yükseltgenme: İnanç2+ → İnanç3+
Azaltma: Cr2Ey72- → Cr3+
Demir atomları zaten dengede olduğundan (1: 1), yükü dengelemek için ürünlerin yanına bir elektron eklenir.
inanç2+ → İnanç3+ + ve-
Şimdi, Cr atomları dengelenir ve denklemin sağ tarafına iki tane eklenir. Sonra, reaksiyon asit ortamda gerçekleştiğinde, yedi H molekülü eklenir.2Veya oksijen atomlarını dengelemek için ürünlerin tarafında.
Cr2Ey72- → 2Cr3+ + 7H2Ey
H atomlarını dengelemek için on dört H iyonu eklenir.+ reaktanların tarafında ve malzemeyi eşitledikten sonra, aynı tarafta altı elektronun eklenmesiyle yükler dengelenir.
Cr2Ey72- +14H+ + 6e- → 2Cr3+ + 7H2Ey
Son olarak, her iki yarı reaksiyon da eklenir, ancak oksidasyon reaksiyonunda sadece bir elektron olduğundan, bunların tümü altı ile çarpılmalıdır..
6Fe2+ + Cr2Ey72- +14H+ + 6e- → İnanç3+ + 2Ch3+ + 7H2O + 6e-
Son olarak, küresel iyonik denklemin her iki tarafında elektronlar elimine edilmeli, yüklerinin ve maddelerin doğru şekilde dengede olduğunu doğrulayın.
referanslar
- Chang, R. (2007). Kimya. (9ncı ed). McGraw-Hill.
- Hein, M. ve Arena, S. (2010). Üniversite Kimyasının Temelleri, Alternatif. Books.google.co.ve adresinden alındı
- Tuli, G.D. ve Soni, P.L. (2016). Kimya Dili veya Kimyasal Denklemler. Books.google.co.ve adresinden alındı
- Hızlı Yayıncılık (2015). Kimya Denklemleri ve Cevapları (Hızlı Çalışma Kılavuzları). Books.google.co.ve adresinden alındı


