Maddenin Karakteristik Özellikleri (Fiziksel ve Kimyasal)
Maddenin karakteristik özellikleri bir maddeyi diğerinden ayırt etmeye veya ayırt etmeye yardımcı olabilecek kimyasal veya fiziksel özelliklerdir. Fiziksel özellikler duyularla gözlenen bir maddenin özellikleridir. Kimyasal özellikler, kimyasal reaksiyon sırasında bir maddenin bir maddeden diğerine nasıl değiştiğini tanımlayan özelliklerdir..
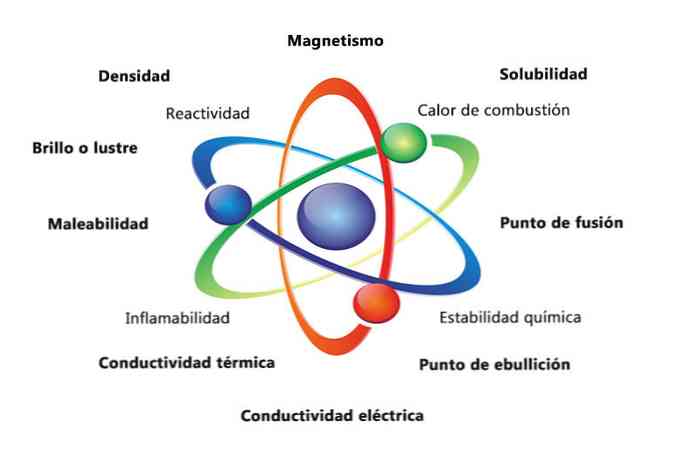
Bir maddenin bazı fiziksel özellikleri yoğunluk, çözünürlük, erime noktası, renk ve kütledir. Malzemenin kimyasal özellikleri yanıcılık, asitlerle reaktivite ve korozyon içerir. Maddenin özelliklerinin bir elementi tanımlamaya nasıl yardımcı olabileceğine dair bazı örnekler, farklı elementlerin yoğunluklarını karşılaştırmaktır..
Altın gibi bir element santimetre küp başına 19.3 gram yoğunluğa sahipken kükürt yoğunluğu santimetre küp başına 1.96 gramdır. Benzer şekilde, su ve izopropil alkol gibi maddelerin erime noktaları farklıdır.
Maddenin fiziksel özellikleri
Maddenin fiziksel özellikleri, maddenin kimyasal yapısını değiştirmeden ölçülebilen veya gözlenebilen özelliklerdir. Bazı fiziksel özelliklere örnekler:
- Yoğunluk: Nesnesi olan maddenin miktarı, kütlenin hacme bölünmesiyle hesaplanır..
- Manyetizma: bir mıknatıs ve manyetik bir nesne arasındaki çekim kuvveti.
- Çözünürlük: Bir maddenin başka bir maddede ne kadar iyi çözünebileceğinin ölçümü.
- Erime noktası: bir maddenin katıdan sıvıya değiştiği sıcaklık.
- Kaynama noktası: bir maddenin sıvıdan gaza değiştiği sıcaklık.
- Elektriksel iletkenlik: elektrik akımlarının bir maddeden ne kadar iyi geçtiğinin bir ölçüsüdür.
- Isı iletkenliği: bir maddenin ısı transfer hızı.
- Erişilebilirlik: Bir maddenin çeşitli şekillerde yuvarlanması veya öğütülmesi.
- Parlaklık veya parlaklık: nesnenin ışığı ne kadar kolay yansıttığı.
Maddenin kimyasal özellikleri
Kimyasal özellikler, bir maddenin kendisini farklı özelliklere sahip yeni bir maddeye dönüştürme yeteneğini tanımlar. Aşağıda birkaç kimyasal özellik örneği bulunmaktadır:
- Yanma ısısı: Bir bileşik oksijenle tam bir yanmaya maruz kaldığında salınan enerjidir..
- Kimyasal stabilite: bir bileşiğin su veya hava ile reaksiyona girip girmeyeceğini belirtir (kimyasal olarak stabil maddeler reaksiyona girmez).
- Alev alma: bir bileşiğin aleve maruz kaldığında yanması.
- Tepkime: başka bir maddeyle etkileşime girme ve bir veya daha fazla yeni madde oluşturma yeteneği.
Maddenin fiziksel halleri
Mesele, bir alanı işgal eden, kütlesi olan ve duyularımız tarafından algılanabilen bir şeydir. Madde fiziksel durumuna göre sınıflandırılabilir: katı, sıvı ve gaz.
1- Katılar ve karakteristik özellikleri
Tüm katılar kütleye sahiptir, bir alanı kaplar, tanımlanmış bir hacme ve şekle sahiptir, boşlukta kaymaz ve sıkıştırılamaz veya katı bir yapıya sahip olamaz. Örnek olarak; tahta, kitap, sünger, metal, taş vb..
Katılarda, maddenin küçük parçacıkları birbirine çok yakındır ve birbirine dokunur. Parçacıklar birbirine çok yakın, çok fazla hareket edemezler, aralarında çok az yer vardır.
2- Sıvılar ve karakteristik özellikleri
Tüm sıvılar kütleye sahiptir, yer kaplar, tanımlanmış bir hacme sahiptir, ancak tanımlanmış bir şekle sahip değildir (bulundukları kaba adapte oldukları için) çok küçük bir dereceye kadar sıkıştırılabilirler ve boşlukta kayabilirler. Örnek olarak; su, gazyağı, yağ vb..
Sıvılarda, maddenin küçük parçacıkları birbirlerinden biraz uzaktadır, aralarında daha fazla boşluk vardır (katılara kıyasla) ve birbirlerine dokunmazlar. Bu nedenle, parçacıklar boşluklar arasında hareket edebilir, sürekli olarak yön değiştirerek diğer parçacıklarla iterek ve çarpışarak.
3- Gazlar ve karakteristik özellikleri
Tüm gazlar kütleye sahiptir, yer kaplar, tanımlanmış bir hacme veya şekle sahip değildir, büyük ölçüde sıkıştırılabilir ve uzaya yayılabilir. Örnek olarak; hidrojen, oksijen, azot, karbon dioksit, buhar vb..
Gazlarda, maddenin küçük parçacıkları çok daha fazladır, aralarında çok fazla boşluk vardır (sıvılarla karşılaştırıldığında) ve birbirlerine dokunmazlar. Parçacıklar maksimum hareket serbestliğine sahiptir, bu nedenle sürekli değişen yöndeki diğer parçacıklar ile itilir ve çarpışırlar.
Maddenin halindeki değişiklikler
Madde katı halden bir sıvı haline ve bunun tersi ve sıvı halinden bir gaz haline ve tam tersi duruma dönüştürülebilir. Bu dönüşüm, maddenin durumunun değişmesi adını alır ve sıcaklıktaki değişimlerden kaynaklanır:
birleşme
Sıcaklığın artmasıyla malzemenin halinin katıdan sıvıya dönüşmesi. Katı bir madde ısıtıldığında, ısı parçacıkların daha kuvvetli titremelerine neden olur.
Erime noktasına ulaştıktan sonra, katı parçacıklar, onları sabit pozisyonlarda tutan enerjisel çekim kuvvetlerinin üstesinden gelmek için yeterli kinetik enerjiye sahiptir ve küçük sıvı parçacık grupları oluşturmak için kırılırlar..
Kaynama veya buharlaşma
Sıcaklığın artmasıyla sıvı maddenin halinin gaz halinde olması. Bir sıvı madde ısıtıldığında, ısı parçacıkların daha da hızlı hareket etmesini sağlar.
Kaynama noktasına ulaşıldığında, sıvı tanecikler, kendilerini sabit pozisyonlarda tutan ve ayrı ayrı gaz halindeki taneciklere ayrılan çekim kuvvetlerini yenmek için yeterli kinetik enerjiye sahiptir..
Donma veya katılaşma
Sıvı maddenin halinin sıcaklık düşüşüyle katıya dönüşmesi. Bir sıvı madde soğutulduğunda, parçacıkları çok fazla kinetik enerji kaybeder. Donma noktasına ulaşıldığında parçacıklar hareket etmeyi durdurur ve sabit bir pozisyonda titreyen katı parçacıklar haline gelir.
Sıvılaşma veya yoğunlaşma
Gaz halindeki havanın halinin sıcaklıktaki düşüş ile sıvıya dönüşmesi. Gaz halindeki bir madde soğutulduğunda, parçacıkları birbirlerini çekmelerine neden olan ve sıvı parçacık haline gelmelerini sağlayan çok fazla kinetik enerjiyi kaybeder..
yüceltme
Bazı malzemeler sıvı halinden geçmeden doğrudan katı hallerinden gaz hallerine veya tam tersi şekilde değişir. Bu katı maddeler ısıtıldığında parçacıkları o kadar hızlı hareket ederler ki buhar veya gaz oluşturan tamamen ayrılırlar ve işlem gazdan katı maddeye çıktığında bunun tersi olur..
referanslar
- De Podesta, M. Maddenin özelliklerini anlama, 2. baskı. Büyük Britanya: Taylor & Francis.
- Goel A. Maddenin halleri. Yeni Delhi: Keşif Yayınevi.
- Moore J, Stanitski C. Moleküler bilim, 5. baskı. Stamford: Cengage Öğrenme.
- Ramakrishna A. Maddenin doğası, 1. baskı. Yeni Delhi: Goyal Kardeşler Prakashan.
- Reger D, Goode S, Ball D. Kimya. İlke ve uygulama, 3. baskı. Kanada: Brooks / Cole, Cengage Öğreniyor.
- Shapere D. Madde (fizik). Erişim yeri: accessscience.com.
- Singh L, Kaur M. Çevremizdeki madde. Hindistan: S. Chand Okulu.


